Klonování zájmových genů do plazmidového vektoru
Oxford Genetics
- Výběr klonovacího systému a plazmidového vektoru
- Restrikční digesce plazmidu
- Restrikční digesce fragmentu
- Excise z gelu
- Clean-up of Gel-Fragments
- Annealing DNA Oligos for Ligation
- Přidání 5' fosfátů k DNA
- Defosforylace DNA
- Příprava DNA pro klonování s buntem
- Ligování DNA pro získání plazmidu obsahujícího gen zájmu
- Mutageneze řízená místem
Výběr klonovacího systému a plazmidového vektoru
Genetické inženýrství se používá v tisících laboratořích po celém světě. Vzhledem k jeho významu je pozoruhodné, že klonovací strategie pro mnoho oblíbených složek DNA nejsou standardizovány. K tomuto nedostatku standardizace přispívá mnoho dostupných možností klonovacích souprav a inovativních technologií. Není vždy nutné používat IP- těžkou soupravu, protože tradiční klonování pomocí štěpení restrikčními enzymy je ještě jednodušší díky standardizovaným plazmidům od společnosti Oxford Genetics.
Cílem společnosti Oxford Genetics bylo vytvořit systém DNA plazmidů, který by dokázal pojmout většinu funkčních inzertů DNA, které může výzkumník požadovat v rámci jednoho plazmidu. Optimalizací našeho výchozího vektoru lze každou složku DNA našeho systému vyjmout a vyměnit za stovky jiných úseků DNA, které jsme předem navrhli a otestovali. To je koncepce SnapFast™ . Všechny naše konstrukty byly předem prověřeny na špatné použití kodonů a konfliktní restrikční místa. Tam, kde to bylo možné, byly vzácné kodony a restrikční místa odstraněny, aby byla umožněna efektivní exprese a aby restrikční místa neomezovala klonování dalších úseků DNA SnapFast.
Máme jednu z největších celosvětově dostupných sbírek plazmidů, která poskytuje více možností exprese a klonování téměř pro každý námi poskytovaný insert. Náš sortiment zahrnuje např:
- Největší rozsah peptidových značek kdekoli jinde (26)
- Celkem 9 reportérových genů v 5 konfiguracích
- Více než 20 signálních peptidů
- Více než 40 promotorů pro expresi u savců, bakterií a kvasinek
- Celkem 10 možností výběru antibiotik a metabolických látek
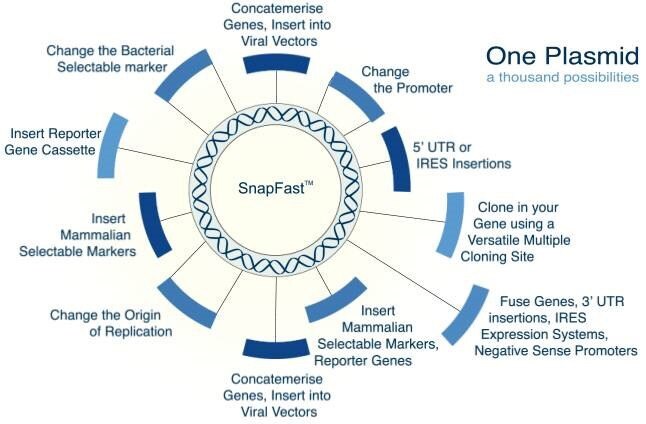
Výhody systému SnapFast
- Všechny plazmidy jsou kompatibilní se standardním klonováním, LIC, InFusionHD, Gibson Assembly, Seamless Geneart.
- K dispozici je více než 1600 unikátních úseků DNA, které jsou kompatibilní.
- Snadné, efektivní a jednoduché inženýrské strategie.
- Vysoká úspěšnost díky předpřipravené kompatibilitě.
- Žádná omezení velikosti insertu. Nízký původ kopií pro zvýšení stability.
- Kompatibilita s mnoha již existujícími klonovacími vektory a řadou raketoplánových vektorů pro usnadnění přenosu genů.
- Snadné klonování z vektorů SnapFast do řady alternativních systémů, včetně virových vektorů.
- Vestavěné regulační sekvence a možnosti (např. konkatameraci genů, izolátory a terminátorové sekvence).
* Vyžaduje návrh primerů pomocí homologických míst nebo míst TypeIIS
** Patenty omezují použití klonovací technologie nebo produktů
^ Nástroje dostupné online, které pomáhají s návrhem
LIC = Ligase Independent Cloning
Restrikční digesce plazmidu
Přípravná digesce je řezání DNA za účelem její přípravy na ligaci s jiným kusem DNA, nikoliv pouze za účelem potvrzení identity DNA. Měli byste se snažit připravit trávení fragmentu i vektoru současně. Ušetříte tak čas. Tento protokol předpokládá roztok plazmidu v pufru Tris-EDTA (TE) nebo Elution buffer (EB) nebo H2O bez nukleáz, který má 200-300 ng/µl a přibližně 3-5 kb. Větší plazmidy mohou vyžadovat použití většího objemu, protože při stejné koncentraci bude méně kopií plazmidu.
V tomto konkrétním příkladu by bylo možné postupovat následovně:
10-20 µl plazmidu (200-300 ng/μl, celkové množství 3-5 µg)
10 µl 10X restrikčního pufru
10 µlL 10X hovězího sérového albuminu (BSA, konečná koncentrace je obvykle 100 µg/ml) (katalogové č. 1), a to v množství cca 10 µg/ml. A7906)
1,5-2 µl restrikčního enzymu 1 (10-20 jednotek/µl)
1.5-2 µl Restrikčního enzymu 2 (volitelně)
Doplňte až 70 nebo 100 µl celkového objemu pomocí TE (katalogové číslo: 2), který se používá k výrobě restrikčních enzymů. T9285) nebo vodou bez nukleázy (kat. č. T9285). W4502)
Výše uvedená činidla přidejte do sterilní 1,5 ml Eppendorfky, nejprve přidejte TE nebo vodu, pak plazmid/DNA, poté restrikční pufr a BSA a důkladně promíchejte. Nakonec přidejte restrikční enzym(y). Výběr restrikčních enzymů závisí na vašich cílech a mapě plazmidu, ale může zahrnovat EcoR I, BamH I nebo Hind III. Reakci inkubujte při správné teplotě (obvykle 37 °C, ale vždy se ujistěte, že se nejedná o výjimku, například SwaI při 25 °C) a spusťte budík (počítejte). Reakce probíhá 40-60 minut. Nyní můžete vektor odfosforylovat pomocí alkalické fosfatázy (CIP). Možná budete chtít v tomto okamžiku deaktivovat restrikční enzymy, je to standardní postup.
Provedete digesci na agarózovém gelu (s velmi velkou jamkou pro načtení velkého vzorku) a zkontrolujete výsledky, zda se na něm nachází jediný pás o velikosti vašeho linearizovaného plazmidu. Existují tři možné výsledky tohoto trávení:
- nefungovalo vůbec. Nemá smysl provádět delší digesci, protože reakce selhala. Pokud enzym již dříve fungoval na jiném plazmidu, možná znovu vysrážejte plazmid, který se snažíte řezat, nebo proveďte novou fenolovou extrakci před vysrážením a zkuste to znovu. V opačném případě zkontrolujte, zda je enzym stále v pořádku, použitím jiného plazmidu.
- pracoval, ale vektor není po 40 minutách zcela rozřezán (viditelné jako přítomnost více než jednoho pásu o přibližné molekulové hmotnosti, kterou od vektoru očekáváte). Podle průběhu můžete odhadnout, jak dlouho to bude trvat, a zkusit další trávení.
- bylo trávení kompletní. Získali jste lineární plazmid, který je připraven k použití v postupu ligace.
Tip: Restrikční enzymy jsou velmi citlivé na změnu teploty, proto je nedávejte na led. Ideální je použít chladicí box o teplotě -20 °C. Také se vyhněte jejich přidržování prsty na dně zkumavky a snažte se při manipulaci se zásobami enzymů pracovat rychle. Pokud se o ně budete starat, vydrží dlouho.
Restrikční digesce fragmentů
Toto je protokol pro přípravné štěpení, což je řezání DNA za účelem její přípravy na ligaci s jiným kusem DNA, nikoli pouze za účelem potvrzení identity DNA. Obvykle jsou těmito kusy DNA kruhové plazmidy, ale mohou to být také fragmenty PCR. Měli byste se snažit připravit trávení fragmentu i vektoru současně. To vám později ušetří čas.
Tento protokol předpokládá roztok plazmidu v pufru Tris-EDTA (TE) nebo Elution buffer (EB) nebo H2O bez nukleáz, který má 200-300 ng/µl a přibližně 3-5 kb. Větší plazmidy mohou vyžadovat použití většího objemu, protože při stejné koncentraci bude méně kopií plazmidu.
V tomto konkrétním příkladu by se dalo postupovat takto:
10-20 µl plazmidu (200-300 ng/µl, celkové množství 3-5 µg)
7,5 µl 10X restrikčního pufru
7. Restrikční pufr (10x), 7,5 µl restrikčního pufru (10x).5 µl 10X hovězího sérového albuminu (BSA, konečná koncentrace je obvykle 100 µg/ml) (katalogové číslo: BSA). A7906)
1,5-2 µl restrikčního enzymu 1(10-20 u/µL)
1. Vložte do misky s vodou.5-2 µl restrikčního enzymu 2 (volitelně)
Doplňte celkem až 70 µl s TE (kat. č. 2), který se používá k výrobě restrikčních enzymů. T9285) nebo vodou bez nukleázy (kat. č. 2), nebo T9285). W4502)
Protokol restrikční digesce fragmentů DNA
Přidejte výše uvedená činidla do sterilní 1.5 ml Eppendorfky, přidejte nejprve TE nebo vodu, poté plazmid/DNA, poté restrikční pufr a BSA a důkladně promíchejte. Nakonec přidejte restrikční enzym(y). Reakci inkubujte při správné teplotě (obvykle 37 °C, ale vždy se ujistěte, že se nejedná o výjimku, například SwaI při 25 °C) a spusťte budík (počítejte). Reakce probíhá 40-60 minut. Proveďte štěpení na agarózovém gelu (s velmi velkou jamkou pro vložení velkého vzorku) a zkontrolujte výsledky, zda se v něm nachází jediný pás o velikosti vašeho inzertu.
Gelová excize fragmentů DNA
K excizi pásu budete potřebovat čistý skalpel nebo žiletku. Důležitým faktorem je množství agarosy, které s DNA odebíráte. Čím vyšší je poměr mezi množstvím DNA a agarózy, tím méně kontaminantů se vám přenese do ligace.
Standardní metodou používanou k extrakci DNA z agarózových gelů je vizualizace barvení ethidium bromidem (katalogové číslo H5041) pomocí UV světla. Tento postup není ideální, protože UV záření poškodí DNA a může způsobit mutace a snížit účinnost ligace. Alternativou je použití transiluminátoru Clare Chemical Dark Reader, ale někdy může být obtížné vidět pásy s nízkým množstvím. Pokud máte značné množství DNA, jsou tyto systémy ideální. Alternativně můžete provést slepou excizi tak, že do pruhu sousedícího s velkou jamkou vložíte malé množství vaší řezané DNA a využijete její polohu k excizi velkého množství DNA v další jamce. Při této technice buďte velmi opatrní, protože některé pásy mohou být v gelu poměrně malé podélně/od shora dolů a mohou být přehlédnuty, pokud nejste přesní. Po vyříznutí se můžete podívat na zbývající gel, abyste zjistili, zda jste pásek získali, udělejte to rychle, protože pokud jste DNA nezískali, nechcete ji poškodit UV zářením.
Dávejte pozor na fragmenty DNA, které jsou blízko sebe. Klíčem této techniky je oddělit páteř vektoru od fragmentu, aby nedošlo ke kontaminaci. To, že při vyříznutí něco nevidíte, neznamená, že to tam není, uvidíte pouze vrchol Gaussova rozložení DNA, a i když pásy mohou vypadat odděleně, nemusí tomu tak být a můžete získat část DNA z pásů, které jsou náhodou blízko.
Tip: Jedná se o poměrně nebezpečný postup, co se týče molekulární biologie. UV světlo, karcinogenní ethidium bromid a skalpel jsou receptem na katastrofu. Dodržujte všechna místní bezpečnostní pravidla a předpisy a pokud si nejste jisti, jaká opatření je třeba přijmout, poraďte se s místním bezpečnostním pracovníkem.
Tip: Zvažte, zda pro vizualizaci DNA nezvolit bezpečnější chemikálii. Jak Nancy 520 (katalogové číslo 01494), tak i Syber Safe (katalogové číslo 01494). S9305 a S9430) se ukázaly být méně mutagenní než ethidium bromid.
Čištění gelových fragmentů
Pro extrakci fragmentu DNA z agarózového gelu se obvykle nevyplatí použít nic jiného než připravenou soupravu, jako je GenElute™ Gel Extraction Kit, katalogové číslo. NA1111. Jsou relativně levné a vysoce účinné. Existují i jiné metody, které nevyžadují soupravu (jako je dialýza hadičkou a rozmáčknutí fragmentu gelu mezi parafilmem, aby se vytlačila DNA v roztoku), ale při použití těchto metod často dochází k vysokému množství kontaminantů a nízkým výtěžkům DNA.
Soupravy pro extrakci DNA z gelu se obvykle skládají buď z kuliček, nebo ze spinových kolonek. Velikosti fragmentů DNA, které jednotlivé soupravy pojmou, se mohou lišit, proto si ověřte, zda souprava extrahuje rozsah velikostí DNA, se kterým pracujete. Většina souprav pokrývá rozmezí 100 bp - 5 Kb, ale některé mají nižší nebo vyšší kapacitu.
Principem souprav se spinovou kolonou i s kuličkami je navázání DNA na něco (obvykle na křemičitou pryskyřici) a následné promytí kontaminantů, a to buď peletováním kuliček, nebo promytím kolony. V závěrečném kroku eluce se DNA uvolní z pryskyřice/perliček/kolony a získáte čistý fragment DNA. I ta nejlepší extrakční souprava však může přenášet některé kontaminanty, a proto je třeba se vyhnout použití velkých objemů roztoku, který byl získán gelovou extrakcí, při ligaci. Při přidávání fragmentu do ligace někdy platí, že "méně znamená více". Snažte se vyhnout tomu, aby se ligace skládala z více než 30 % objemu tekutiny izolované extrakcí gelem.
Variabilita soupravy pro extrakci gelem
V našich laboratořích jsme testovali šest různých souprav pro extrakci DNA gelem, a to přímo mezi sebou, protože tento proces je pro naši práci velmi důležitý. Zjistili jsme, že zatímco některé soupravy neustále poskytují vysoké výtěžky a čistou DNA, jiné někdy poskytují dobré výtěžky, ale někdy selhávají, a jiné trvale nedosahují dostatečných výsledků.
Pokud extrahujete fragment z plazmidu pomocí gelu, měli byste pravděpodobně očekávat, že čísla koncentrace DNA (pokud používáte spektrofotometr) budou nízká, protože jste začali s velkým plazmidem (nejspíše kolem 5 kb), pak jste vyřízli mnohem menší podfrakci (možná 1 kb) a soupravy nikdy nevyčistí 100 % DNA zpět z gelu. Takže výtěžnost 20 ng/ul v celkovém objemu 35ul pro 1Kb fragment izolovaný z 5ug plazmidové DNA (5Kb) by nebyla špatná (bylo získáno 70 % DNA).
Často zjišťujeme, že důležitějším faktorem určujícím úspěšnost klonování je často úroveň kontaminantů nebo kvalita přípravy DNA než samotná výtěžnost DNA. Také jsme trvale pozorovali, že někdy přidání většího množství fragmentů do ligace snižuje úspěšnost klonování ve srovnání se stejnou reakcí s o něco menším množstvím. Ačkoli to může být jednoduše proto, že dodatečné konce DNA titrují ligázu od konců vektoru, přidání příliš velkého množství materiálu extrahovaného z gelu může přispívat kvůli nízkému množství kontaminantů v přípravku z gelu.
Annealing DNA Oligos for Ligation
Základní koncepce žíhání oligos spočívá v zahřátí dvou oligonukleotidů tak, aby došlo k jejich denaturaci, a poté následuje období chlazení, aby se obě oligos mohly spárovat. Pro vlastní oligos viz OLIGO). Tento postup se často používá k přípravě krátkých úseků DNA pro:
- Vytvoření oblastí DNA shRNA pro ligaci
- Vytvoření oblastí DNA mikroRNA pro ligaci
- Přidání linkeru pro odstranění nebo přidání restrikčního místa.
- Studie vyžadující malé dvouvláknové oblasti DNA, například testy vazby DNA na proteiny.
Náklady na nákup velkého množství fosforylovaných olig mohou být neúnosné. Z tohoto důvodu mnoho skupin jednoduše liguje oligos do vektorů, které nebyly odfosforylovány. Tento postup je zvláště účinný v případě, že oligos mají být ligovány do vektoru, který byl rozřezán dvěma různými restrikčními enzymy, které mají nekompatibilní konce (brání uzavření vektoru na sebe). Pozadí z ligování může být stále vysoké, ale oligos jsou často v oligoligacích ve značném přebytku, a tak by reakce měla stále fungovat.
Je také možné oligos nejprve fosforylovat pomocí polynukleotidové kinázy (PNK), ale čištění oligos je obtížné, protože se pravděpodobně nebudou vázat na kolonku pro čištění DNA kvůli své krátké délce. Reakce PNK se však provádějí v ligázovém pufru, takže to nemusí být nutné, ale PNK musí být před vložením oliga do ligatury tepelně inaktivována, jinak PNK fosforyluje váš vektor.
Na fosforamiditovou chemii, pomocí které se oligos obvykle vyrábějí, se lze obvykle spolehnout při výrobě 40-50 bází bez větších chyb, nicméně použití této techniky k výrobě oligos o délce 100 bází a více často vede k mutacím. Často jsme zjistili, že je lepší rozdělit dlouhé oligo na dvě kratší oliga s překrytím 10-15 párů bází uprostřed na protilehlém oligu, aby se mohly spojit. Četnost mutací, které získáte po sekvenování, by měla být mnohem nižší.

Zvažte krok chlazení. Zkoušeli jsme chladit oligos ve vodní lázni jednoduše tak, že jsme ji zahřáli na 95 stupňů a pak jsme ji vypnuli, aby se ochladila, nebo tak, že jsme je zahřáli na 100 stupňů v kádince na stativu (stará škola) a pak jsme kádinku vložili do ledové vody (a oligos v trubičce uvnitř kádinky stále), aby se ochladily. Zkoušeli jsme také umístit oligos do PCR přístroje nastaveného na ochlazování po 5 stupních každých 30 sekund. Skutečnost je taková, že metoda nemá velký význam. Ponechat je příliš dlouho při vysoké teplotě by mohlo vést k hydrolýze, proto se vyhýbáme pouhému vypnutí vodní lázně. Obecně zahříváme oligos na 95 stupňů ve vodní lázni v kádince se zkumavkou s oligos v eppendorfce na plováku. Tu pak vložíme na 10 minut do ledové vody. Zdá se, že nám to funguje dobře, ale ostatní metody mohou fungovat i u vás.
Navržení olig s přesahy, které rekonstituují místa, do nichž má být oligo vloženo, může být obtížné. Toto schéma níže poskytuje příklad, jak mohou oligos vypadat, v tomto příkladu mají být oligos ligovány do restrikčních míst NcoI a XbaI.

Protokol žíhání DNA oligos
Tip: Zásoby oliga a primerů jsou často resuspendovány v koncentraci 100 µM (100 pikomolů/ul).
- Přidejte 10 µl zásobních olig (za předpokladu, že máte dvě k žíhání) do 25 µl vody bez nukleázy (katalogové číslo:
Přidejte 10 µl zásobních olig (za předpokladu, že máte dvě k žíhání) do 25 µl vody bez nukleázy (katalogové číslo:
Přidejte 10 µl zásobních olig. W4502) do 1,5 ml mikrozkumavky.
- Přidejte 5 µl restrikčního pufru (např. 100mM NaCl (kat. č. S3014), 50 mM Tris-HCl (kat. č. S3014), 5 µl pufru pro restrikční štěpení (např. 93362), 10 mM MgCl2 (kat. č. M0250), 1 mM Dithiothreitol (katalogové číslo D0632), pH 7,9. Přítomnost pufru pomáhá udržovat správné pH pro stabilitu DNA a sůl by měla podporovat žíhání. Koncentrace oliga je nyní 20 pikomolů/ul.
- Plavte zkumavku v kádince ve vodě předehřáté na 95 stupňů po dobu 5 minut.
- Kádinku vložte do boxu na led, který je naplněn ledem a vodou, aby se kádinka mohla chladit po dobu 10 minut.
- Po ochlazení vody v kádince nařeďte oligosložky 10krát a 100krát ve vodě a přidejte 1 µl této směsi do standardní 20 µl ligační reakce. Je pokušením přidat více, ale tím jen titrujete ligázu z konců vašeho vektoru na další oligos, což může snížit účinnost ligace. Konečná koncentrace oligos v ligaci by měla být přibližně 2 nebo 0,2 pikomolu/µl. To bude stále značný přebytek olig vůči vektoru.
Přidání 5' fosfátů k DNA
DNA ligáza T4 vyžaduje ke spojení DNA 5' fosfát na jedné z ligovaných molekul DNA, z tohoto důvodu je často nutné molekulu DNA před přidáním k ligování fosforylovat, například při tupém klonování produktu PCR.
Protokol fosforylace DNA
Voda bez obsahu nukleázy (Katalogové číslo. W4502): 4,5 ul
Produkt PCR nebo jiná DNA (vyčištěná): (pokud má váš produkt PCR 5' zapuštěné nebo tupé konce, zahřejte jej na 70 °C po dobu 5 minut a před přidáním do reakce jej zchlaďte na ledu)
10 x T4 DNA ligázový pufr: 1 ul (ligázový pufr se používá proto, že obsahuje ATP)
T4 polynukleotidová kináza: 0,5 ul
Inkubujte kinázovou reakci (reakce) 30 minut při 37 °C. Fosforylovaný produkt PCR lze poté použít přímo v ligační reakci bez čištění (například při provádění mutageneze řízené na místě). Pokud má být produkt PCR ligován do de-fosforylovaného vektoru, může být vhodné enzym PNK tepelně inaktivovat, aby nedošlo k fosforylaci páteřního vektoru a vysokému pozadí. Toho se dosáhne inkubací reakce (reakcí) po dobu 20 minut při 65 °C.
Defosforylující DNA
Účelem defosforylace vektoru je zabránit jeho zpětné vazbě během kroku ligace odstraněním 5' fosfátových skupin, které jsou vyžadovány DNA ligázou ke spojení fosfodiesterové páteře DNA. Existují různé alkalické fosfatázy, včetně telecí střevní fosfatázy (CIP), krevetové a antarktické fosfatázy. CIP (Katalogové číslo: CIP). P4978) je nejběžnější, ale je obtížné ji tepelně inaktivovat. Teplota a pufry různých enzymů se mohou lišit, viz pokyny výrobce.
Protokol defosforylace DNA pro defosforylaci DNA v restrikční reakci
50-100 µ.L DNA (5 µg) v restrikční štěpné reakci/roztoku
1-2 µl enzymu CIP (1jednotka/µl)
- Přidejte 1-2 µl enzymu CIP do restrikční štěpné reakce. CIP je stabilní a aktivní ve většině restrikčních štěpicích pufrů.
- Inkubujte vzorek 30-60 minut při 37 °C.
Protokol defosforylace DNA pro defosforylaci DNA v TE nebo H2<./sub>O
20-40 µl DNA (5µg) v TE (kat. č. T9285) nebo nukleáza H2O (kat. č. W4502)
5 µl 10xCIP pufru
.
1-2 µl enzymu CIP (1jednotka/µl)
Doplňte až 50 µl
- Ve sterilní 1.5 ml eppendorfky přidejte DNA, poté CIP pufr a poté 1-2 µl CIP.
- Důkladně promíchejte pipetovou špičkou a inkubujte 30-60 minut při 37 °C.
Tip 1: Ujistěte se, že váš fragment, který budete ligátovat do defosforylovaného vektoru, má 5'fosfátové skupiny. Standardní oligos/primery a produkty PCR obvykle nejsou fosforylované a musí být ošetřeny polynukleotidkinázou T4 (viz fosforylace 5' konců). Obvykle je jednodušší přidat restrikční místa na konce produktu PCR (plus několik párů bází navíc na koncích), než fragment fosforylovat.
Tip 2: CIP se kvůli stabilitě skladuje v glycerolovém pufru, což ale znamená, že klesá na dno vodných roztoků. Při přidávání CIP sledujte jeho pokles do směsi DNA tak, že to uděláte se zkumavkou přidrženou před sebou, a pak zajistěte, aby byl před inkubací znovu řádně suspendován.
Protokoly klonování tupé DNA
Někdy je například nutné ztupit konce molekuly DNA:
- Při tvorbě knihovny DNA
- Otřepená DNA s roztřepenými konci, kterou je třeba klonovat do vektoru
V situaci, kdy není možné zvolit kompatibilní restrikční místa, vyžadující otupení vektoru a inzertu nebo obou před ligací (může být poslední možností). Existují dvě možnosti, buď použít DNA polymerázu (jako je Klenow nebo T4), nebo nukleázu Mung bean. Klenow a T4 DNA polymerázy vyplňují 5' převisy a přežvýkávají 3' převisy. Pokud potřebujete doplnit 5' převis, bude vám vyhovovat kterýkoli z těchto enzymů, ale pokud potřebujete odstranit 3' převis, může být lepší volbou T4, protože má silnější 3' až 5' exonukleázovou aktivitu. Nukleáza z mungo fazolí přežvýká jak 5', tak 3' převis.
Klenow Blunting Protocol
- DNA by měla být rozpuštěna v 1x restrikčním pufru nebo v T4 DNA Ligase Reaction Buffer doplněném o 33 μM každého dNTP [konečná koncentrace].
- Přidejte 1 jednotku Klenowa na mikrogram DNA a inkubujte 15 minut při 25 °C.
- Reakci zastavíme přidáním EDTA na konečnou koncentraci 10 mM a následným zahříváním při 75 °C po dobu 20 minut.
Metoda T4 Blunting
- DNA by měla být rozpuštěna v pufru 1x restriction digest buffer & doplněném o 100 µM dNTPs [final].
- Přidejte 1 jednotku T4 DNA polymerázy na 1 mikrogram DNA a inkubujte 15 minut při 12 °C.
- Reakci zastavte přidáním EDTA na konečnou koncentraci 10 mM a zahříváním na 75 °C po dobu 20 minut.
Metoda otupení nukleázou z fazolí
- Suspendujte DNA (0.1 μg/μl) v 1X pufru Mung Bean Nuclease nebo v pufru restrikčního enzymu
- Přidejte 1,0 jednotky Mung Bean Nuclease na μg DNA.
- Inkubujte při 30 °C po dobu 30 minut.
NESNAŽTE se tepelně inaktivovat nukleázu Mung bean, protože před inaktivací enzymu se mohou objevit jednovláknové oblasti DNA, což může vést k nechtěné degradaci. Inaktivujte enzym purifikací na spinové koloně nebo extrakcí fenolem/chloroformem a srážením etanolem.
Protokol ligace DNA
Během procesu klonování vedou všechny cesty k ligaci, a proto všechny kroky, které jí předcházejí, mohou výrazně ovlivnit její účinnost. Je důležité, abyste si před samotnou ligační reakcí přečetli rady a poznámky v jednotlivých oddílech.
Ligační reakce se nastavují spolu s kontrolami. Obvykle máte dvě kontroly, kterými jsou:
- Samotný vektor bez ligázy (kontrola pro neříznutý vektor)
- Vektor s ligázou (kontrola pro nedostatečnou defosforylaci při použití ve spojení s kontrolou 1)
- Skutečná ligace, což je vektor + fragment + ligáza.
Pokud jste získali kolonie na kontrole 1, pak restrikční trávení vašeho vektoru nefungovalo, protože jste získali kolonie i bez ligázy. Pokud jste dostali kolonie na kontrole 2, ale ne na kontrole 1, pak vaše ošetření alkalickou fosfatázou nefungovalo. Je to proto, že vaše trávení fungovalo dobře (žádné kolonie na kontrole 1), ale ligáza byla schopna znovu zakroužkovat plazmid, protože během defosforylace nebyly odstraněny 5' fosfáty. Pokud jste získali kolonie na 3 a žádné (nebo jen méně) na 1 a 2, pak byste si měli pogratulovat, vybrat několik kolonií a jít domů na šálek čaje a oslavit to.
Podmínky reakce se mohou v různých laboratořích lišit. Nejlepších výsledků se dosahuje při teplotě 16 °C přes noc, ale to znamená přidat k celému procesu den navíc (takže jde o čtyřdenní klonovací cyklus). Provedení ligace při pokojové teplotě po dobu 1-2 hodin obvykle poskytuje dobré výsledky a zkracuje klonování na 3 dny pro celý cyklus. To platí za předpokladu, že vám nevadí dlouhý první den.
Dva nejobtížnější typy ligace jsou ligace produktů PCR a tupá ligace. Měli byste počítat s tím, že budou méně účinné než standardní klonování fragmentu z jednoho vektoru do druhého.
Typickou reakci lze nastavit takto:
- Začněte přípravu reakce přidáním komponent, které jsou společné pro všechny reakce, tj. přidejte vodu, pak pufr a pak vektor do každé ze zkumavek.
- Poté přidejte fragment do ligační zkumavky.
- Nakonec přidejte ligázu do ligační zkumavky a správné kontrolní zkumavky. Reakci nevířte, protože DNA ligáza je citlivá na střih. Místo toho promíchejte špičkou, kterou jste ligázu přidali, a to tak, že dobře promícháte a/nebo zkumavku opakovaně jemně přejeďte prstem.
- Inkubujte buď 1-2 hodiny při pokojové teplotě, nebo přes noc při 16 °C. Někteří lidé ligování tepelně inaktivují při 65 °C po dobu 20 minut, ale není to nezbytně nutné.
- Po dokončení ligování použijte plazmid k transformaci bakterií, abyste mohli buď přímo exprimovat protein, nebo vypěstovat mnoho kopií DNA plazmidu pro další použití.
Tip 1: BSA v ligázovém pufru se může při rozmrazování vysrážet, což je vidět jako bílá sraženina na dně pufru. Znovu ji suspendujte vortexováním a dočasným zahřátím mezi prsty nebo při 37 °C.
Tip 2: Ligázový pufr obsahuje ATP, který se po několika cyklech zmrazování a rozmrazování rozkládá. Zásoby pufrů uchovávejte v malých alikvotech a po >3 cyklech je vyhoďte.
Tip 3: Zahřátí ligatury (před přidáním enzymu) na několik minut na 37 °C otevře lepivé konce nebo pomůže linearizovat přechodně recirkulované vektory při použití ligatury s jedním restrikčním místem. Před přidáním enzymu ligování ochlaďte na pokojovou teplotu, abyste nepoškodili ligázu při přidávání enzymu. My to neděláme, ale slyšeli jsme, že to může pomoci od jiných, kteří to dělají.
Tip 4: Uvádí se, že ošetření produktů PCR Proteinázou K před ligací pomáhá při ligování. Extrakce produktu PCR z gelu by byla zbytečná, stejně jako použití soupravy pro čištění PCR k jeho přečištění.
Tip 5: Při extrakci z gelu nevystavujte DNA UV záření. To může v některých případech dramaticky snížit účinnost ligace.
Tip 6: Nepoužívejte více než 20-30 % celkového objemu ligace (obvykle je celkový objem 20 μl) materiálu přečištěného gelem. Pokud tak učiníte, může být v reakci příliš mnoho soli a dalších kontaminantů a účinnost ligace se může snížit.
Tip 7: Množství vektoru by mělo být sotva viditelné, pokud byste jej spustili na agarózovém gelu, tedy asi 20-30 nanogramů. Fragmentů by mělo být více, ale ne více než 5-10krát koncentrovanější ve srovnání s vektorem. Obvykle používáme poměr vektoru k fragmentu 1:2 nebo 1:3.
Výpočet poměru insertu k vektoru
Molární poměr insertu k vektoru může mít významný vliv na výsledek ligace a následných transformačních kroků. Molární poměry se mohou pohybovat od poměru 1:1 pro insert k vektoru až po poměr 10:1. Pro dosažení nejlepších výsledků může být nutné vyzkoušet několik poměrů souběžně. Níže uvedený výpočet vám řekne, jaké množství fragmentu k nám patří při poměru 6:1 (fragment:vektor). Pro výpočet alternativních koncentrací změňte číslo 3 na libovolné.

Site Directed Mutagenesis Protocol
Mutageneze řízená místem (SDM) je užitečná technika pro zavedení specifické mutace do plazmidu na konkrétním místě. Mutace může být substituce, inzerce nebo delece. SDM má mnoho aplikací, například k posouzení funkce určitých aminokyselin v enzymu, ke zkoumání účinku změny bází v promotoru nebo odstranění restrikčních míst z plazmidu.
Popisujeme zde metodu mutageneze řízené na místě založenou na PCR. Základním principem je navrhnout dvojici primerů PCR zády k sobě tak, aby byl celý plazmid amplifikován pomocí PCR. Jeden z těchto primerů obsahuje požadovanou mutaci. PCR vytvoří lineární produkt, jehož konce lze poté spojit (po fosforylaci) pomocí DNA ligázy. Takto zcyklený vektor se transformuje do E. coli.
Krok 1: Postup mutageneze a návrh primerů
Navrhněte dvojici primerů, která bude obsahovat požadovanou mutaci na 5' konci jednoho z nich. Navrhněte je tak, aby komplementární oblast měla Tm přibližně 60 °C.
Příklad:

Všimněte si, že mutaci obsahuje pouze přední primer, takže můžete snadno vytvořit řadu různých mutací tak, že zachováte stejný reverzní primer, ale použijete různé přední primery. Výše uvedený příklad představuje záměnu 3 bp, ale stejným způsobem lze provést i inzerci. Pokud potřebujete velmi rozsáhlou substituci nebo inzerci, pak lze mutované báze zavést na 5' konec obou primerů.
Delece libovolné velikosti lze provést tak, že přední a reverzní primery na templátu umístíte od sebe.
Primery pro PCR se obvykle dodávají bez fosfátové skupiny na 5' konci vzhledem ke způsobu jejich syntézy. To znamená, že konce produktu PCR nelze jednoduše spojit k sobě, musí být nejprve fosforylovány. Existují dvě hlavní možnosti, jak to provést: 1) můžete si objednat primery s již přidaným fosfátem na 5' konec, nebo 2) můžete produkt PCR fosforylovat pomocí polynukleotidkinázy (PNK). Fosforylované primery jsou dobrým nápadem, pokud děláte jen několik SDM a nemáte v mrazáku PNK (navíc tím odpadá jeden krok). Použití PNK je cenově výhodnější, pokud děláte hodně SDM (pravděpodobně 10 nebo více).
Krok 2: PCR
Důležité je použít korektorovací polymerázu, aby se zabránilo vnesení dalších mutací. Pokud byste se přesto obávali vnesení mutací, můžete po mutagenezi zmutovaný fragment subklonovat zpět do stejné kostry.
Protože je tato metoda založena na PCR, má tendenci fungovat lépe na menších plazmidech. Nejlépe je postupovat podle pokynů dodávaných s polymerázou, ale PCR nastavte podobně jako v tomto příkladu:
35,5 μl vody
5 μl 10x polymerázového pufru
1,5 μl forwardového primeru (0. 3μM final)
1,5 μl reverzního primeru (0.3 μM final)
5ul dNTPs (200 μM final)
1ul Templátové DNA (ředění 1:100 z minipřípravku)
0,5 μL polymerázy
Reakci postavte na led a zkumavku ihned po promíchání reakce přeneste do předehřátého PCR bloku.
Program PCR:
- 98 °C 60 sekund
- 98 °C 8 sekund
- 55-65 °C 20 sekund
- 72°.C (doba elongace závisí na velikosti plazmidu a typu použité polymerázy) opakujte/cyklujte kroky 2-4 ještě 27-30krát
572 °C 5 minut
Podržte při pokojové teplotě.
Krok 3: Vyčištění produktu PCR
Celou reakci proveďte na agarózovém gelu. Vyřízněte pás a vyčistěte DNA pomocí soupravy pro extrakci z gelu a eluujte ji v 30 μl.
Krok 4: Fosforylujte 5' terminály
*Tento krok lze vynechat, pokud jste při PCR použili fosforylovaná oligos.
4,5 μl vody bez nukleázy (katalogové číslo:
Voda bez nukleázy. W4502)
PCR produkt
1 μl 10x T4 DNA ligázový pufr*
0.5 μl T4 polynukleotidkinázy
Inkubujte při 37 °C po dobu 40 minut.
*Ligázový pufr se používá proto, že již obsahuje ATP a PNK je v něm aktivní.
Krok 5: Ligatujte konce DNA
Nastavte ligační reakci na led.
6. Vložte do ledové nádoby a zkontrolujte, zda je v ní uložena DNA.7 μl vody bez nukleázy (katalogové číslo: 6), - 7 μl vody bez W4502)
2 μL PNK Reakce (z kroku 5)
0.8 μl 10x T4 DNA ligázového pufru
0,5 μl T4 DNA ligázy
Inkubujte při 16 °C přes noc nebo při pokojové teplotě po dobu 2 hodin.
Krok 6: Transformace do kompetentního E. coli
Krok 7: Potvrďte mutaci sekvenováním DNA
.Abyste mohli pokračovat ve čtení, přihlaste se nebo vytvořte účet.
Nemáte účet?