Alkaloidy Cinchona
Asymetryczna kataliza przeniesienia fazy (PTC) została uznana za "zieloną" alternatywę dla wielu homogenicznych syntetycznych transformacji organicznych i znalazła szerokie zastosowanie. Syntetycznie modyfikowane alkaloidy cynamonowe są typowymi chiralnymi organokatalizatorami stosowanymi w asymetrycznej PTC. Opracowano kilka generacji O-alkilowych N-arylometylowych pochodnych, które ostatecznie doprowadziły do wysoce enancjoselektywnych reakcji alkilowania imin glicyny w celu wygenerowania szeregu pochodnych α-aminokwasów (Tabela 1).
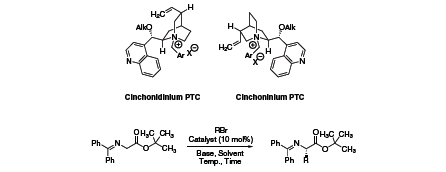
Rysunek 1. Reakcje alkilowania imin glicynowych
W celu dalszej poprawy enancjoselektywności katalizatora, Jew i Park połączyli dwie grupy alkaloidu cynchony za pomocą jednostek dystansowych. Z takim dimerycznym alkaloidem cynchony (06542), enancjoselektywność dla wyżej wspomnianej alkilacji imin glicyny została zoptymalizowana do 97-99% ee.1,2,3
Katalizatory nukleofilowe odegrały szeroką rolę w rozwoju nowych metod syntetycznych. W szczególności, alkaloidy cynchony katalizują wiele użytecznych procesów z wysoką enancjoselektywnością. Alkaloidy cynamonowe mogą być stosowane jako zasady do deprotonowania substratów za pomocą stosunkowo kwaśnych protonów tworzących kontaktową parę jonową między powstałym anionem a protonowaną aminą. Interakcja ta prowadzi do powstania chiralnego środowiska wokół anionu i umożliwia enancjoselektywne reakcje z elektrofilami.
W wielu z tych procesów ważna jest zdolność do kontrolowania tworzenia czwartorzędowych centrów asymetrycznych z wysokimi nadmiarami enancjomerycznymi. Stosując katalizator (DHQD)2AQN (456713) można wpływać na α-funkcjonalizację ketonów poprzez addycję TMSCN do odpowiedniej cyjanohydryny z doskonałą wydajnością i nadmiarem enancjomerycznym (Schemat 1).4
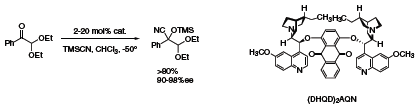
Schemat 1
Bezmetalowa reakcja aminowania allilowego stanowi użyteczne rozszerzenie konwencjonalnej metodologii π-allilowej katalizowanej palladem. Aminacja diimidami w odległej pozycji γ może być przeprowadzona przy użyciu (DHQ)2PYR (418978) (Schemat 2), tworząc różnorodny zakres wysoce sfunkcjonalizowanych związków aminowych.5
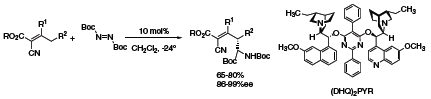
Schemat 2
Wreszcie, Jørgensen i współpracownicy opracowali pierwszą katalityczną enancjoselektywną sprzężoną addycję do alkinonów przy użyciu (DHQ)2PHAL (392723).6 Zarówno dla aromatycznych jak i alifatycznych alkinonów addycja β-diketonów przebiega z wysoką wydajnością i enancjoselektywnością dając mieszaninę (E)- i (Z)-enonów (Schemat 3).
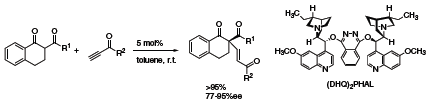
Schemat 3
Materiały
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?