Purifikace nebo odstranění proteinů a peptidů s exponovanými aminokyselinami: His, Cys, Trp a/nebo s afinitou k iontům kovů
Chelating Sepharose High Performance, Chelating Sepharose Fast Flow, Capto Chelating
Proteiny a peptidy, které mají afinitu k iontům kovů, lze separovat pomocí imobilizované chromatografie s afinitou kovů, IMAC. Kovy jsou imobilizovány na chromatografické médium chelatací. Některé aminokyseliny, například histidin a cystein, tvoří komplexy s chelátovanými kovy při neutrálním pH (pH 6,0 až 8,0) a za vazbu chelátovaného kovu je zodpovědný především obsah histidinu v proteinu.
IMAC je vynikající pro purifikaci rekombinantních (his)6 značených proteinů (viz příručka Affinity Chromatography Vol. 2: Tagged Proteins, 18114275) i mnoha přírodních proteinů. Chelatující sepharosa, médium používané pro IMAC purifikaci proteinů s exponovanými His, Cys a Trp, vzniká spojením ligandu tvořícího chelát kovu (kyselina iminodioctová) se sepharosou.
Před použitím se médium zatíží roztokem dvojmocných kovových iontů, jako jsou Ni2+, Zn2+, Cu2+ nebo Co2+. Vazebná reakce s cílovým proteinem je závislá na pH a navázaný vzorek se eluuje snížením pH a zvýšením iontové síly pufru nebo zařazením imidazolu do pufru. Struktura ligandu, kyseliny imidodioctové, je znázorněna na obrázku 1.
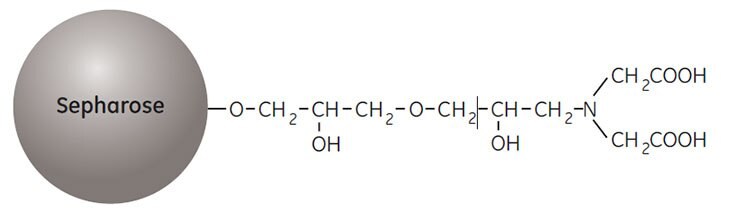
Obrázek 1.Částečná struktura chelatační sepharosy High Performance a chelatační sepharosy Fast Flow.
Metaloproteiny obvykle nejsou vhodnými kandidáty pro purifikaci pomocí chelatační chromatografie, protože mají tendenci vychytávat ionty kovů z kolony.
Chromatografické vlastnosti média
1 Krátkodobé se vztahuje na interval pH pro regeneraci, čištění na místě a sanitační postupy. Dlouhodobý se týká intervalu pH, při kterém je médium dlouhodobě stabilní bez nepříznivých účinků na jeho následnou chromatografickou výkonnost.
Varianty purifikace
.1 Převod rychlosti flow (cm/h) na objemovou rychlost flow (ml/min) viz příloha 4. Maximální provozní flow se vypočítá z měření v plněné koloně s výškou lože 10 cm a i.d. 5 cm.
Výběr kovového iontu
Při předběžných experimentech lze použít následující pokyny pro výběr kovového iontu, který je pro danou separaci nejvhodnější:
- Cu2+ poskytuje silnou vazbu a některé proteiny se vážou pouze na Cu2+. Během nabíjení vložte roztok kovových iontů odpovídající 60 % objemu naplněné kolony, abyste zabránili úniku kovových iontů během aplikace vzorku. Alternativně lze médium nasytit a za hlavní kolonu zapojit krátkou sekundární nenabitou kolonu HiTrap® Chelating HP nebo balenou Chelating Sepharose Fast Flow, která zachytí přebytečné ionty kovů.
- Zn2+ poskytuje slabší vazbu a toho lze v mnoha případech využít k dosažení selektivní eluce směsi proteinů. K nabití kolony vložte roztok kovových iontů odpovídající 85 % objemu naplněné kolony.
- Ni2+ se běžně používá pro proteiny s jeho značkami. Roztok Ni2+ odpovídající polovině objemu kolony je obvykle dostatečný k nabití kolony.
- Co2+ a Ca2+ jsou také alternativy.
Nabíjejte kolonu ionty kovů tak, že přes kolonu projdete roztokem příslušné soli, například ZnCl2, NiSO4 nebo CuSO4 v destilované vodě. Pro jiné kovy lze použít chloridové soli.
K určení, kdy je kolona nabitá, lze použít několik metod. Pokud se při nabíjení použije roztok soli kovu v destilované vodě, má eluát zpočátku nízké pH a při nasycení média ionty kovu se vrací k neutrálnímu pH. Průběh nabíjení Cu2+ lze snadno sledovat okem (obsah kolony zmodrá). Při nabíjení kolony zinečnatými ionty lze ke zjištění přítomnosti zinku v eluátu použít uhličitan sodný. Po nabití kolony důkladně promyjte médium vazebným pufrem.
Výběr vazebného pufru
Neutrální nebo mírně alkalické pH zvýhodňuje vazbu. Vhodnými pufry jsou tris-acetát (50 mM), fosforečnan sodný (20 až 50 mM) a Tris-HCl (20 až 50 mM). Tris-HCl má tendenci snižovat vazbu a měl by se používat pouze v případě, že je afinita kovu k proteinu poměrně vysoká.
Vysoké koncentrace soli nebo detergentů v pufru obvykle nemají na adsorpci proteinu žádný vliv a je dobré udržovat vysokou iontovou sílu (např, 500 mM až 1 M NaCl), aby se předešlo nežádoucím účinkům iontové výměny.
Neměla by se zařazovat helační činidla, jako je EDTA nebo citrát, protože z prostředí odstraňují ionty kovů.
Výběr elučních pufrů
Diferencované eluce vázaných látek lze dosáhnout pomocí gradientu činidla, které konkuruje buď ligandu, nebo cílovým molekulám. Lze použít zvýšenou koncentraci imidazolu (0 až 500 mM), chloridu amonného (0 až 150 mM) nebo látek, jako je histamin nebo glycin, které mají afunkci pro chelátovaný kov. Gradient je nejlépe provádět ve vazebném pufru při konstantním pH.
Protože pH řídí stupeň ionizace nabitých skupin ve vazebných místech, lze pro nespecifickou eluci vázaného materiálu použít gradient nebo postupné snižování pH. Normální je rozmezí pH 7,0 až 4,0, přičemž většina proteinů eluuje v rozmezí pH 6,0 až 4,2. Lze použít deformační eluenty, jako je 8 M močovina nebo 6 M guanidin-hydrochlorid.
Eluce s EDTA (50 mM) nebo jinými silnými chelatačními činidly odstraní ionty kovů a další vázaný materiál. Tato metoda obvykle nerozlišuje různé proteiny.
Pokud jsou použity tvrdé eluční podmínky, doporučuje se eluované frakce okamžitě převést do mírnějších podmínek (buď shromážděním do neutralizačního pufru, nebo předáním přímo na odsolovací kolonu pro výměnu pufru (viz Výměna pufru a odsolování,
.a href="/CZ/cs/technical-documents/protocol/protein-biology/protein-purification/sample-preparation1">Příloha 1).
Ztráta kovových iontů je výraznější při nižším pH. Kolonu není nutné mezi po sobě jdoucími purifikacemi odstraňovat, pokud se bude purifikovat stejný protein.
Ačkoli je únik kovových iontů velmi nízký, přítomnosti jakéhokoli volného kovu v purifikovaném produktu lze zabránit připojením nenabité kolony HiTrap® Chelating HP v sérii za první kolonou a před elucí proteinu. Tato kolona naváže veškeré ionty kovů a odstraní je z proteinu při průchodu druhou kolonou.
Provedení separace
Tento protokol lze použít jako základ, na jehož základě lze vyvinout purifikační metody pro proteiny a peptidy s affikací na ionty kovů:
- Roztok kovových iontů: 100 mM CuSO4
- Vazný pufr: 20 mM fosforečnan sodný, 500 mM NaCl, 10 mM imidazol, pH 7,4
- Eluční pufr: 20 mM fosforečnan sodný, 500 mM NaCl, 500 mM imidazol, pH 7.4
K vymytí roztoku pro uchovávání kolony, který obsahuje 20% ethanol, použijte vodu, nikoli pufr. Tím se vyhnete riziku vysrážení niklových solí v dalším kroku. Pokud je v koloně zachycen vzduch, promyjte ji destilovanou vodou, dokud se vzduchové bubliny nevypudí.
- Promyjte kolonu nejméně 2 CV destilované vody.
- Na kolonu nalijte 0,5 CV 100 mM roztoku mědi.
- Vypláchněte 5 CV destilované vody.
- Kolonu ekvilibrujte 10 CV vazebného pufru.
- Naneste vzorek rychlostí průtoku 1 až 4 ml/min (1 ml kolona) nebo 5 ml/min (5 ml kolona). Shromážděte průtočnou frakci. Pro použití vzorků o objemu větším než 15 ml je vhodnější použít čerpadlo.
- Propláchněte 10 CV vazebného pufru. Shromážděte promývací frakci.
- Eluujte 5 CV elučního pufru. Sbírejte eluované frakce v malých frakcích, např. 1 ml, aby nedošlo k naředění eluátu.
- Propláchněte 10 CV vazebného pufru. Kolona je nyní připravena k nové purifikaci a jen zřídkakdy je třeba ji znovu zatížit kovem, pokud se má purifikovat stejný protein značený (his)6 .
Zvýšení kapacity
Chcete-li zvýšit kapacitu, použijte několik kolon HiTrap® Chelating HP (1 ml nebo 5 ml) v sérii (uvědomte si, že se zvýší zpětný tlak) nebo pro ještě větší kapacitu zabalte Chelating Sepharose Fast Flow do vhodné kolony (viz Příloha 3).
Čištění
- Odstraňte ionty kovů promytím 5 CV 20 mM fosforečnanu sodného, 500 mM NaCl, 50 mM EDTA, pH 7,4
- Odstraňte vysrážené proteiny filtrací kolony 1 M NaOH a inkubujte 2 hodiny. Rozpuštěné proteiny vymyjte pomocí 5 CV vody a pufru o pH 7,0, dokud pH flotografu nedosáhne hodnoty pH 7,0.
- Případně promývejte neiontovým detergentem, například 0,1% Tween 20, při 37 °C po dobu 1 min.
- Odstraňte lipidy a velmi hydrofobní proteiny promytím 70% ethanolem nebo gradientem 0 %-30 %-0 % isopropanol/voda.
Chemická stabilita
Stabilní ve všech běžně používaných vodných pufrech a denaturantech, jako je 6 M guanidin-hydrochlorid, 8 M močovina a další chaotropní látky.
Skladování
Chromatografická média a kolony promyjte 20% ethanolem při neutrálním pH (pro balená média použijte přibližně 5 CV) a skladujte při teplotě 4 °C až 8 °C.
Před dlouhodobým skladováním odstraňte ionty kovů promytím 5 CV 20 mM fosforečnanu sodného, 500 mM NaCl, 50 mM EDTA, pH 7,4.
Po dlouhodobém skladování je třeba kolonu znovu naplnit ionty kovů.
Materiály
Abyste mohli pokračovat ve čtení, přihlaste se nebo vytvořte účet.
Nemáte účet?