Koktejl inhibitorů fosfatázy
Ian Gleiser, Pnina Yaish, Efrat Barnea-Gedalyahu, Dorit Zharhary
Úvod
Fosforylace je reverzibilní posttranslační modifikace proteinů. Proteinkinázy katalyzují přenos záporně nabité γ-fosfátové skupiny z ATP na hydroxylový postranní řetězec serinových, treoninových nebo tyrosinových zbytků proteinu, čímž se mění konformace a aktivita proteinu. Opačnou reakci, odstranění fosfátu z proteinu neboli defosforylaci, provádějí proteinové fosfatázy.1,2 Tři až čtyři procenta savčích proteinů jsou kinázy a fosfatázy, některé jsou specifické pro několik cílových proteinů, zatímco jiné působí široce na mnoho proteinů.
Fosforylace proteinů je klíčovým regulačním mechanismem, který řídí aktivitu, interakce, lokalizaci a degradaci proteinů. Řídí procesy přenosu signálu, buněčného cyklu, apoptózy, metabolismu a další. Asi třetina proteinů přítomných v typické savčí buňce je fosforylována, mnohé z nich na více místech. Serinová fosforylace tvoří 86 % fosfoproteomu, zatímco threoninová a tyrosinová fosforylace 12 %, resp. 2 %. Řada lidských onemocnění je spojena s abnormální fosforylací buněčných proteinů.3-5
Využití fosforylace/defosforylace proteinu jako kontrolního mechanismu má pro buňku mnoho výhod. Je rychlá, nevyžaduje syntézu nových proteinů ani degradaci proteinů a jedná se o reverzibilní reakci.
Při studiu buněčných procesů zahrnujících fosforylaci proteinů, jako jsou signální kaskády a interakce protein-protein, nebo při analýze fosforylovaných míst na proteinu a purifikaci fosfoproteinu je nezbytné inhibovat buněčné proteinové fosfatázy inhibitory fosfatáz. To umožňuje zmrazení fosforylačního stavu cílového proteinu/proteinů ve zvoleném časovém okamžiku. Fosforylační databáze www.phosphosite.org uvádí 80 000 fosforylačních míst. Detekce většiny z nich by nebyla možná bez použití inhibitorů fosfatáz.
Proteinové fosfatázy
Proteinové fosfatázy se dělí do podkategorií na základě jejich substrátové specifity (Tabulka 1).
- Alkalická fosfatáza6-8 - Rodina nespecifických fosfatáz, která je zodpovědná za odstraňování fosfátových skupin z mnoha typů molekul, včetně proteinů, nukleotidů a alkaloidů. Izoenzymy alkalické fosfatázy savců jsou inhibovány analogy homoargininu a levamisolu. Střevní a placentární izoenzymy však levamizol neinhibuje, ale inhibuje je imidazol.
- Proteinová serin/treonin fosfatáza9,10 - Tato třída fosfoproteinových fosfatáz představuje většinu aktivity Ser/Thr fosfatáz in vivo. Zahrnuje dvě hlavní podtřídy, PP1 a PP2. Ta se dále dělí na základě požadavků na kovové ionty: PP2A, která nevyžaduje ionty kovů, PP2B, která je stimulována vápníkem, a PP2C, která je závislá na Mg2+ . Ser/Thr fosfatázy jsou inhibovány mnoha malými molekulami z mořských hub, půdních streptomycet a dalších. Nejznámějšími jsou kyselina okadaová, kalikulin A, microcystin-LR, tautomycin, fostriecin a kantaridin. Aktivity těchto sloučenin mají různou specifitu vůči různým Ser/Thr fosfatázám.11
- Protein tyrosin fosfatáza12 - Skupina enzymů, které odstraňují fosfátové skupiny z fosforylovaných tyrosinových zbytků na bílkovinách pomocí enzymového meziproduktu cysteinylfosfátu. Tyto enzymy jsou klíčovými regulačními složkami v signálních transdukčních drahách. Tyrozinfosfatázy jsou inhibovány ortovanadátem a příbuznými sloučeninami a fluoridem sodným.
- Dvojspecifické (Tyr a Ser/Thr) fosfatázy3 - Dvojspecifické fosfatázy jsou podtřídou proteinových tyrozinfosfatáz, které jsou schopny defosforylovat také serinové a threoninové zbytky. Podílejí se na regulaci klíčových buněčných signálních drah. Konkrétní příklady těchto inhibitorů lze nalézt v odkazu.13
Koktejly s inhibitory fosfatáz
Použití inhibitorů fosfatáz je zásadní pro všechny typy studií fosforylace. Nabízíme řadu koktejlů fosfatázových inhibitorů pokrývajících nejširší škálu fosfatáz, abychom zajistili ochranu proteinů před defosforylací. Řada obsahuje 2 koktejly: Koktejl fosfatázových inhibitorů 2 (Kat. No. P5726) a Phosphatase Inhibitor Cocktail 3 (Cat. No. P0044). Phosphatase Inhibitor Cocktail 3, náš nejnovější koktejl inhibitorů fosfatáz, je směs inhibitorů fosfatáz zaměřená na Ser/Thr fosfatázy. Koktejl inhibitorů fosfatáz 3 nahrazuje koktejl inhibitorů fosfatáz 1 (Kat. No. P2850). Rozdíl mezi oběma koktejly spočívá v tom, že nový koktejl Inhibitor fosfatázy 3 obsahuje kalikulin A místo mikrocystinu-LR v koktejlu Inhibitor fosfatázy 1. Tabulka 2 uvádí seznam inhibitorů v jednotlivých koktejlech.
Experimentální výsledky
Následující experimentální údaje porovnávají inhibiční účinek nového koktejlu inhibitoru fosfatázy 3 a koktejlu inhibitoru fosfatázy 1 (kat. č. P2850), který nahrazuje. Z údajů vyplývá, že aktivita obou koktejlů je rovnocenná.
Je důležité zmínit, že pro inhibici širokého spektra fosfatáz a účinné snížení celkové aktivity fosfatáz se doporučuje používat oba naše koktejly inhibitorů fosfatáz, koktejl inhibitorů fosfatáz 2 (Kat. No. P5726) a Phosphatase Inhibitor Cocktail 3 (Cat. No. P0044).
Endogenní aktivita podobná PP1α v různých buněčných a tkáňových extraktech byla měřena pomocí radioaktivního substrátu 32P-Ser fosforylázy A při pH 7,5, 30 °C. Koktejl inhibitorů fosfatáz 1 (kat. č. P2850) nebo koktejl inhibitorů fosfatáz 3 (kat. č. P0044) byly přidány k extraktům v konečné koncentraci 1 % při 30 °C, 5 minut před testováním aktivity podobné PP1α. Aktivity uvedené na obrázku 1 jsou relativní, nikoli absolutní. Čím menší je zbývající aktivita, tím větší je stupeň inhibice koktejlem, který byl do reakce vložen.
* Hodnota zjištěná u těchto vzorků je příliš nízká na to, aby byla v grafu vidět, a je velmi blízká nule.
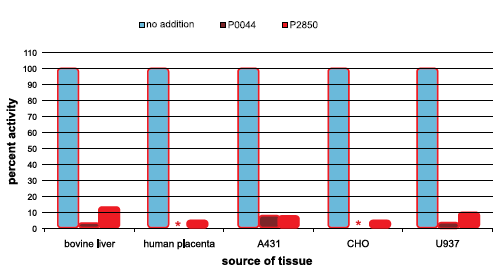
Obrázek 1.Inhibice aktivity podobné PP1α v buněčných a tkáňových extraktech
Inhibice aktivity podobné proteinové fosfatáze 1α
Koktejl inhibitorů fosfatáz 3 (Cat. No. P0044) je účinný inhibitor aktivity Protein phosphatase 1α-like v buňkách a tkáních. Následující experimenty prokazují jeho inhibiční účinnost a porovnávají ji s účinností dřívějšího koktejlu inhibitoru fosfatáz 1 (Kat. No. P2850).
Lidská placenta vykazuje 10-20krát vyšší PP1α-like aktivitu na mg proteinu než jiné tkáňové extrakty. Proto byla vybrána k prokázání účinnosti inhibice koktejlů inhibitorů fosfatáz.
Endogenní aktivita podobná PP1α v extraktu lidské placenty byla měřena pomocí radioaktivního substrátu P-Ser fosforylázy A při pH 7,5, 30 °C. Různá množství koktejlu inhibitorů fosfatáz 1 (Kat. No. P2850) nebo Fosfatase Inhibitor Cocktail 3 (Cat. No. P0044) byly přidány k extraktu při 30 °C, 5 minut před testováním aktivity podobné PP1α.
Endogenní aktivita podobná AP v extraktu z hovězích jater byla měřena v kolorimetrickém testu s použitím pNPP jako substrátu při pH 10,4, 37 °C. Inhibice byla provedena inkubací extraktu s koktejlem fosfatázového inhibitoru 3 (Cat. No. P0044) samostatně nebo společně s koktejlem fosfatázového inhibitoru 2 (Cat. No. P5726), po dobu 3 minut při 37 °C před testováním AP-like aktivity.
Inhibice aktivity alkalické fosfatáze (AP) podobné
Jak bylo uvedeno výše, různé izoenzymy alkalické fosfatázy jsou inhibovány různými inhibitory. Koktejl fosfatázových inhibitorů 3 (Kat. No. P0044) silně inhibuje L-izoformy alkalické fosfatázy přítomné v extraktech z hovězích jater a vykazuje synergický účinek při aplikaci s koktejlem inhibitorů fosfatázy 2 (Cat. No. P5726). (Obrázek 3A).
Koktejl inhibitoru fosfatázy 3 (Kat. No. P0044) má malý vliv na inhibici aktivity P-izoforem alkalické fosfatázy, které jsou v extraktech lidské placenty hojně zastoupeny, a proto se inhibice dosahuje použitím koktejlu inhibitoru fosfatázy 2 (Cat. No. P5726 (obrázek 3B).
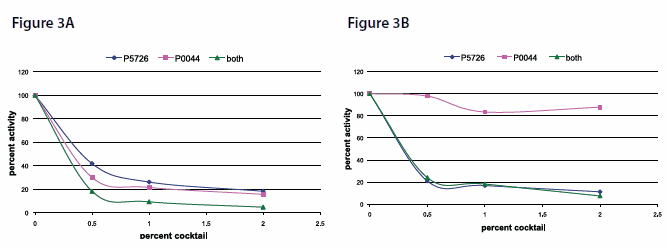
Obrázek 3A a B.Dávkově závislá inhibice aktivity alkalické fosfatázy (AP) v extraktu z hovězích jater
Materiály
Abyste mohli pokračovat ve čtení, přihlaste se nebo vytvořte účet.
Nemáte účet?