Chirální pomocné látky TADDOL (α,α,α,α-tetra./b>aryl-1,3-dioxolan-4,5- dimethanols) vyvinuté Seebachovou skupinou našly četné uplatnění v asymetrické syntéze, od využití jako stechiometrická chirální činidla nebo v reakcích zprostředkovaných Lewisovou kyselinou až po roli v katalytické hydrogenaci a stereoregulární metatezové polymeraci.1
Nukleofilní adice
Hlavní oblastí použití TADDOLů jsou dosud enantioselektivní reakce katalyzované Ti. Nukleofilní adice organokovových sloučenin na aldehydy jsou znázorněny v Schématu 1. Příprava Ti-TADDOLátového komplexu používaného při těchto transformacích je kritická s ohledem na reprodukovatelnost.1
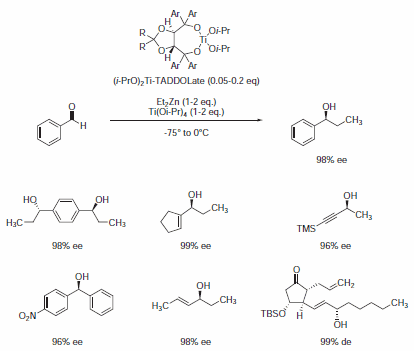
Schéma 1
Enantioselektivní přenosy allylových skupin na aldehydy jsou nejúspěšnější pomocí Duthalerových komplexů CpTi-TADDOLate 449520./b> nebo 449539 (Schéma 2).2
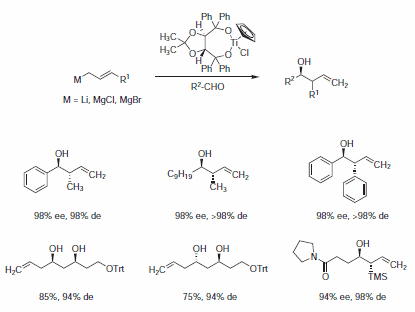
Schéma 2
Enantioselektivní transesterifikace
Bylo zaznamenáno několik příkladů enantioselektivních transesterifikací pro otevírání kruhů laktonů a cyklických anhydridů pomocí Ti-TADDOLátu z .nbsp;393762 (Schéma 3). Pozorovaná selektivita v tomto desymetrizačním kroku je do značné míry nezávislá na struktuře. Získané poloestery se snadno převádějí na odpovídající γ-laktony.3
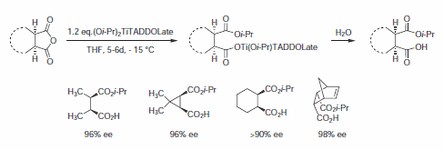
Schéma 3
Je třeba zmínit, že TADDOL 395242 ložisko 1-naftylovou skupinou se vzácně liší svou reaktivitou od ostatních TADDOLů (dramatická ztráta enantioselektivity je pozorována v dříve popsaných adičních reakcích katalyzovaných Ti-TADDOLátem). Tuto změnu reaktivity lze vysvětlit vyšší sterickou překážkou v okolí chirální kapsy aktivního místa.4
Enantioselektivní protonace
Překvapivě stereoselektivní příklady s použitím TADDOL 395242 byly nalezeny v enantioselektivních protonizačních reakcích (Schéma 4),5 první příklad katalytické enantioselektivní fluorinační reakce, o které informovali Hintermann a Togni, použil Cl.sub>2Ti-komplex z 395242 (Schéma 5)6 stejně jako nedávný příklad, o němž informoval Rawal s použitím schématu 5.nbsp;395242 jako organokatalyzátor s Brønstedovou kyselinou ve vysoce enantioselektivní hetero-Diels-Alderově reakci (Schéma 6).7
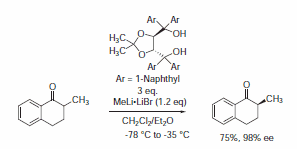
Schéma 4

Schéma 5
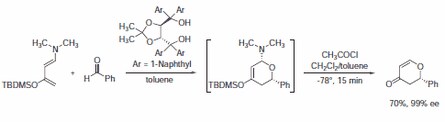
Schéma 6
Materiály
Odkazy
Abyste mohli pokračovat ve čtení, přihlaste se nebo vytvořte účet.
Nemáte účet?