Příprava vzorku pro Western Blotting
Důležitost kvalitní přípravy vzorku nelze dostatečně zdůraznit. Pokud pochopíte povahu výchozího vzorku a budete mít jasnou představu o informacích, které chcete z experimentů Western blottingu získat, zvýšíte své šance na úspěšnou analýzu. Důraz tohoto protokolu je proto kladen na základní pravidla správné praxe při přípravě vzorků, která vám pomohou zajistit, abyste vše od začátku zvládli správně.
V zásadě platí, že všechny zdroje bílkovin, od jednotlivých buněk až po celé tkáně, stejně jako extracelulární matrice, biologické tekutiny a bílkoviny vylučované in vitro, lze analyzovat metodou Western blotting. Zatímco zdroje, jako jsou savčí buňky v suspenzi, jsou za mírných podmínek snadno narušitelné a snadno uvolňují své bílkoviny, je obtížnější extrahovat bílkoviny z buněk hluboko uložených v neporušených tkáních nebo v pevných nádorech. Extrakci proteinů z rostlin, bakterií a hub dále komplikuje přítomnost tuhé buněčné stěny bohaté na sacharidy, která obklopuje a chrání živou buňku.
Nezávisle na zdroji a proteinu, který vás zajímá, však musí být cílem navrhnout dostatečně agresivní postup extrakce, který umožní přístup k buňkám a jejich narušení, aniž by došlo k nevratným změnám samotných proteinů, které vás zajímají, a zároveň získáte dostatečný výtěžek materiálu s přijatelnou úrovní čistoty.
Příprava vzorku - buďte šetrní! Zůstaňte v klidu!
- Používejte co nejšetrnější extrakční postupy:
- Příliš razantní narušení buněk nebo tkání může vést k přímé denaturaci cílové molekuly, tvorbě trvalých proteinových komplexů, chemickým modifikacím nebo k uvolnění kompartmentalizovaných proteolytických enzymů.
- Extrahujte proteiny rychle, pokud možno na ledu, v přítomnosti vhodného pufru k udržení pH, iontové síly a stability, aby se zabránilo degradaci proteinů. Předchlaďte zařízení a vzorky uchovávejte stále na ledu.
Biologické matrice jsou složité. Cílový protein bude pravděpodobně jedním z mnoha tisíců proteinů přítomných ve vzorku, kromě nukleových kyselin, polysacharidů a lipidů, které mohou interferovat s analýzou. Úsilí vynaložené na extrakci a purifikaci závisí na konečném cíli; pokud je například cílem detekovat málo početný protein, může být vhodné afinitní izolace tohoto specifického proteinu ze vzorku pomocí techniky, jako je imunoprecipitace. Na druhou stranu lze analýzu robustních a hojných proteinů uspokojivě provést pomocí prakticky nativních vzorků.
Volba metody extrakce závisí především na vzorku a na tom, zda je analýza zaměřena na všechny proteiny v buňce, nebo pouze na složku z určité subcelulární frakce.
Vzhledem k tomu, že při rozrušení buňky může dojít k uvolnění endogenních proteáz, které mohou cílovou molekulu degradovat, měl by být vzorek během rozrušení buňky a následné purifikace chráněn použitím koktejlu inhibitorů proteáz, aby se zabránilo nekontrolovaným ztrátám proteinů.
K dispozici je řada metod pro rozrušení buněk a přípravu jejich obsahu pro analýzu metodou Western blotting. Tabulka 1 uvádí některé z nejoblíbenějších extrakčních metod a uvádí jejich použitelnost pro zpracování konkrétních buněčných nebo tkáňových zdrojů. Obecně platí, že šetrné metody se používají, pokud vzorek sestává ze snadno lyzovatelných kultivovaných buněk nebo krevních buněk, zatímco razantnější metody se používají pro narušení robustnějších bakteriálních nebo rostlinných buněk nebo savčích buněk usazených v pojivové tkáni.
Možnosti extrakce proteinů
Lýza na bázi detergentů
Detergentní lýza je nejčastější metodou volby pro zpracování savčích buněk. Buněčné suspenze se jemně odstředí a resuspendují v lyzačním roztoku obsahujícím detergent. Membrány se rozpustí, buňky se lyzují a uvolní se jejich obsah. Adherentní buňky, jako jsou fibroblasty, mohou být solubilizovány přímo na povrchu tkáňové kultury přidáním lyzačního roztoku nebo mohou být nejprve seškrábnuty z povrchu v přítomnosti nelytického pufru pomocí gumového skalpelu, odstředěny a zpracovány jako buněčné suspenze. Použití jemného neiontového detergentu, jako je Triton** X-100, nonylfenoxypolyetoxyletanol (NP40) nebo zwitteriontový detergent, jako je 3-[(3-cholamidopropyl) dimethylammonio]-1-propansulfonát (CHAPS), pomáhá zajistit, aby denaturace cílových proteinů byla minimální.
Lýza zmrazením/rozmrazením
Tato metoda je použitelná pro suspenze savčích nebo bakteriálních buněk. Hlavními přednostmi lyze zmrazením/rozmrazením jsou jednoduchost a nízké náklady. Buňky jsou narušeny opakovanou tvorbou ledových krystalů a metoda se obvykle kombinuje s enzymatickou lýzou. Buněčnou suspenzi lze rychle zmrazit pomocí kapalného dusíku. Vzorek se poté rozmrazí a resuspenduje pipetováním nebo jemným vířením v lyzačním pufru při pokojové teplotě a proces se několikrát opakuje. Mezi jednotlivými cykly se vzorek odstředí a supernatant se uchová.
Osmotický šok
Jedná se o velmi šetrnou metodu, která může být dostatečná pro lýzu suspendovaných savčích nebo bakteriálních buněk bez použití detergentu. Metoda, často kombinovaná s mechanickým rozrušením, spočívá ve změně z vysokého na nízký osmotický tlak média a je vhodná pro aplikace, při nichž má být lyzát následně frakcionován na subcelulární složky.
Ultrasonizace
Tato metoda extrakce proteinů se nejčastěji používá pro buněčné suspenze. Buňky jsou narušovány vysokofrekvenčními zvukovými vlnami (obvykle 20 až 50 kHz) prostřednictvím sondy vložené do vzorku. Zvukové vlny vytvářejí oblast nízkého tlaku, což způsobuje narušení
membrán buněk v blízkosti hrotu sondy. Buněčné suspenze by měly být sonikovány v krátkých dávkách, aby se zabránilo zahřívání, a vzorky by měly být mezi dávkami chlazeny na ledu. Tento postup je vhodný pro přípravu vzorků v malém měřítku. Agregáty bílkovin (inkluzní tělíska) je třeba resolubilizovat. Ačkoli je ultrazvukování relativně jednoduché, jedná se o přísnou metodu přípravy vzorků, při níž je třeba neustále kontrolovat vznikající teplo a citlivé cílové molekuly mohou být zranitelné střižnými silami.
Poznámka: U proteinových preparátů může uvolnění DNA vést k vysoce viskózním vzorkům, které se obtížně zpracovávají. Viskozitu lze snížit přidáním DNázy.
Mechanické metody
Bílkoviny lze z buněk a tkání extrahovat pomocí řady hrubých, ale účinných "drcení a mletí" opatření. Například buněčné membrány mohou být narušeny střižnými silami kapaliny při protlačování vzorku úzkou mezerou: čím je mezera těsnější, tím větší je střižná síla. Toho lze dosáhnout ručně pomocí douncové homogenizace nebo mechanicky pomocí Potter-Elvehjemovy homogenizace. Tato šetrná metoda je vynikající pro malé objemy a kultivované buňky.
Homogenizace tkání připravených sekáním nebo mletím v chlazeném pufru lze dosáhnout pomocí mixéru Waring nebo Polytron. Polytron se od mixéru Waring liší tím, že tkáň nasává do dlouhé hřídele, která obsahuje rotující nože. K dispozici jsou hřídele s různou kapacitou, které umožňují odebírat vzorky o velikosti pouhého 1 ml.
Mortar a pěchovadlo: Tkáně nebo buňky se obvykle zmrazí v tekutém dusíku a rozemelou na jemný prášek. Přidání oxidu hlinitého nebo písku může usnadnit mletí. Buněčné stěny jsou narušeny mechanickou silou.
Mletí skleněných kuliček: Rychlé míchání buněk jemnými skleněnými kuličkami narušuje buněčné stěny. Mletí kuliček lyzuje většinu grampozitivních i gramnegativních bakterií včetně mykobakterií.
Enzymatické trávení
Enzymatické metody se často používají při extrakci proteinů z bakterií, kvasinek nebo jiných organismů s buněčnými membránami obklopenými robustní ochrannou strukturou. Enzymy rozpouštějí buněčné stěny, obaly, kapsidy, kapsidy nebo jiné struktury, které není snadné stříhat pouze mechanickými metodami. Po enzymovém štěpení často následuje homogenizace, sonikace nebo intenzivní víření v lyzačním pufru. Enzymatické metody se nejčastěji používají pro bakterie a kvasinky, ale lze je použít i pro extrakci proteinů z eukaryotických buněk uložených ve vláknitých tkáních, kde se například kolagenáza může být vhodná k posílení rozkladu fibrilárního kolagenu (tabulka 2).
Explosivní dekomprese
Tato technika se nejčastěji používá u bakterií, kvasinek, rostlinných buněk nebo jiných robustních vzorků. Buňky jsou vyrovnávány inertním plynem, například dusíkem, při vysokém tlaku (obvykle 5500 kPA/800 psi). Při použití francouzského lisu funguje tato metoda prostřednictvím rychlého poklesu tlaku, kdy je vzorek přenesen z komory pod vysokým tlakem přes otvor do komory pod nízkým tlakem. Jedná se o rychlou a účinnou metodu vhodnou pro velké objemy.
Předpřipravené lyzační pufry a soupravy pro přípravu vzorků
Cytiva nabízí řadu produktů pro extrakci proteinů ze savčích buněk, kvasinek, bakterií a živočišných tkání.
Soupravu na rozmělnění vzorků lze použít k rozmělnění malých vzorků tkání a buněk pro extrakci proteinů. Až 100 mg vzorku na zkumavku lze zpracovat za přibližně 10 min. Souprava se skládá z mikrocentrifugačních zkumavek, z nichž každá obsahuje malé množství abrazivní rozmělňovací pryskyřice suspendované ve vodě, a jednorázových pěchovadel. Zkumavka se nejprve odstředí, aby se pryskyřice peletovala, a odstraní se voda. Poté se do zkumavky přidá zvolený extrakční roztok a vzorek a pěchovadlem se vzorek rozemele. Po odstředění jsou buněčné zbytky a rozmělněná pryskyřice pevně usazeny v kuželovitém dně zkumavky a supernatant se snadno odstraní
Na illustraci™. triplePrep™ Kit je určena k rychlé izolaci a purifikaci genomové DNA, celkové RNA a celkových denaturovaných proteinů s vysokým výtěžkem z nedělených vzorků živočišných tkání a savčích buněk. Pracovní postup snižuje celkový počet kroků a umožňuje přípravu všech tří analytů za méně než 1 h. Pufr, kolony a protokol zajišťují vysokou výtěžnost z omezených vzorků, jako jsou biopsie, archivní tkáně a nádory.
Pufr pro extrakci savčích proteinů je určen pro účinnou a šetrnou extrakci biologicky aktivních, celkově rozpustných proteinů z kultivovaných savčích buněk. Tento pufr je založen na organických pufrovacích činidlech a lze jej použít pro buněčné suspenze i adherentní buňky.
Sada pro extrakci proteinů z kvasinek je vhodná pro extrakci rozpustných proteinů z kvasinkových buněk a je patentovaným vylepšením přípravy sféroplastů na bázi zymolázy a extrakce rozpustných proteinů z kvasinkových buněk. Tato souprava obsahuje protokol pro přípravu sféroplastů a odstranění lytického enzymu zymolýzy před lýzou a extrakcí kvasinkových proteinů. Pufr je založen na organických pufrovacích činidlech obsahujících mírné neiontové detergenty a patentované kombinaci různých solí a činidel pro zvýšení extrakce a stability 28-9998-97 AB 19 proteinů. K dispozici je také přípravek Zymolyase připravený k použití. V závislosti na použití lze přidat další činidla, jako jsou redukční činidla, chelatační činidla a inhibitory proteáz. Sada Yeast Protein Extraction Buffer Kit odstraňuje nutnost pracné lýzy kvasinkových buněk pomocí skleněných kuliček.
Sada 2-D Fractionation Kit zjednodušuje analýzu složitých směsí proteinů tím, že snižuje množství a počet druhů proteinů vložených do gelové matrice. Frakcionace umožňuje izolovat skupiny proteinů nebo frakce z celkového proteomu. To umožňuje lepší rozlišení při analýze jednotlivých frakcí, poskytuje méně přeplněné 2-D mapy, zjednodušuje analýzu a interpretaci a zvyšuje šance na objevení nových proteinů diagnostického nebo terapeutického zájmu. Tyto škálovatelné soupravy pomáhají zajistit vysokou výtěžnost vzorků a jsou kompatibilní s navazujícími separačními technikami, jako je 2-D gelová elektroforéza.
Ochrana vzorků
Inhibitory proteáz musí být součástí lyzačních pufrů, aby se zabránilo degradaci proteinů po uvolnění endogenních proteáz během procesu buněčné lyzace.
Směs inhibitorů proteáz: Příprava vzorků často vyžaduje inhibici aktivity proteáz. Společnost Cytiva nabízí tuto jedinečnou kombinaci kompetitivních a nekompetitivních inhibitorů proteáz, které chrání proteiny před proteolýzou během purifikace z živočišných tkání, rostlinných tkání, kvasinek a bakterií. Koktejl obsahující inhibitory serinových, cysteinových a kalpainových proteáz účinně inhibuje více než 95 % proteázové aktivity a byl vyvinut speciálně pro přípravu vzorků při studiích 2-D gelové elektroforézy. Volitelně lze přidat kyselinu ethylendiamintetraoctovou (EDTA) k inhibici metaloproteáz.
Přestože je důležité udržovat proteázy během extrakce proteinů v neaktivním stavu (Tabulka 3), je třeba vzít v úvahu i další potenciálně ohrožující kontaminanty. Pokud je například cílem vašeho Western blotu detekovat fosforylované proteiny, je důležité chránit vzorek před defosforylačním působením fosfatáz uvolněných do lyzátu během přípravy vzorku. Jedním ze způsobů ochrany vzorku je přidání inhibitoru fosfatázy, jako je vanadičnan sodný, do lyzačního pufru. Může být také nutné chránit proteiny před nežádoucími modifikacemi, jako je acetylace, ubikvitinylace nebo glykosylace.
Čištění vzorků
Obvykle není nutné vzorky před 1-D gelovou elektroforézou upravovat, ale je to velmi důležité v aplikacích 2-D gelové elektroforézy. Pokud se však vyskytnou problémy se separací, například rozmazané pásy, může čištění vzorků zlepšit výkonnost odstraněním potenciálně interferujících sloučenin, jako jsou nukleové kyseliny, polysacharidy a soli. Proti problémům s viskozitou způsobeným uvolňováním nukleových kyselin lze například použít přídavek DNázy. Tabulka 4 obsahuje seznam běžných kontaminantů a možnosti, jak se s nimi vypořádat.
Produkty pro čištění vzorků
Sada pro čištění vzorků SDS-PAGE je určena pro přípravu vzorků, které je obtížné analyzovat kvůli přítomnosti solí nebo nízké koncentraci bílkovin (obrázek 1). Tato souprava používá kombinaci precipitantu a koprecipitantu ke kvantitativnímu vysrážení proteinů vzorku, přičemž rušivé látky, jako jsou detergenty, soli, lipidy, fenoly a nukleové kyseliny, zůstávají v roztoku. Proteiny se peletují odstředěním. Peleta se dále promyje, aby se odstranily neproteinové kontaminanty, a znovu se odstředí. Výsledná peleta se resuspenduje, smíchá se s pufrem pro vzorky SDSPAGE a zahřeje se. Vzorek je pak připraven pro SDS-PAGE. Postup lze dokončit za méně než 2 hodiny.

Obrázek 1. Srovnání sady pro čištění SDS-PAGE s ethanolovým srážením. (A) Močový protein vysrážený 10 objemovými dávkami etanolu. (B) Močový protein vysrážený pomocí sady SDS-PAGE Clean-Up Kit. Gel: 8 × 9 cm, 12,5 % akrylamid, 0,1 % SDS, spuštěn na jednotce SE 260 Mini-Vertical. Barvení: Coomassie** Blue R-250.
2-D Clean-Up Kit je určena k přípravě vzorků pro 2-D gelovou elektroforézu (obrázek 2), ale lze ji použít i v aplikacích Western Blotting. Reagencie kvantitativně vysráží proteiny, zatímco rušivé látky, jako jsou detergenty, soli, lipidy, fenoly a nukleové kyseliny, ponechávají v roztoku. Ošetření vzorku pomocí sady 2-D Clean-Up Kit výrazně zlepšuje kvalitu výsledků 2-D gelové elektroforézy, snižuje tvorbu proužků, zabarvení pozadí a další artefakty. Další informace o sadě 2-D Clean-Up Kit naleznete v příručce 2-D elektroforéza, principy a metody od společnosti Cytiva (2).
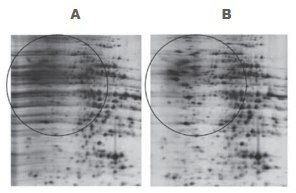
Obrázek 2.Sada 2-D Clean-Up Kit odstraňuje většinu horizontálních šmouh způsobených zbytky SDS. Vzorek: Játra potkana extrahovaná 4% SDS, 40 mM Tris báze. První rozměr: Přibližně 20 μg proteinu krysích jater, Immobiline™ DryStrip (pH 4-7, 7 cm). Izoelektrická fokusační jednotka Ettan™ IPGphor™ 3 17,5 kVh. Druhý rozměr: SDS-PAGE (12,5 %), provedeno na SE 260 Mini-Vertical Unit (8 × 9 cm gel). Barvení: PlusOne™ Silver Staining Kit, Protein.
Odstranění vysoce zastoupených proteinů ze vzorků séra nebo plazmy
Při vyšetřování plazmy nebo séra metodou Western blotting mohou hojné plazmatické proteiny, jako je albumin a IgG, zastínit signály méně zastoupených proteinů. Předbalené kolonky, jako je HiTrap™ Albumin &; IgG Depletion, jsou navrženy tak, aby ze vzorků odstranily tyto potenciálně problematické proteiny, a to >95 % albuminu a >90 % IgG.
Kolona HiTrap Albumin & IgG Depletion o objemu 1 ml je určena k depleci albuminu a IgG ze vzorků o objemu přibližně 150 μl neředěné lidské plazmy nebo séra, které obsahují normální hladiny albuminu (~40 mg /ml) a IgG (~15 mg/ml). Deplece trvá přibližně 35 minut a lze ji provést pomocí kapalinového chromatografického systému z konstrukční platformy ÄKTA™, peristaltické pumpy nebo ručně pomocí injekční stříkačky. Při práci s menšími objemy se doporučuje použít zařízení Albumin &; IgG Depletion SpinTrap™, které je určeno pro objemy ~50 μl lidské plazmy nebo séra.
Desaltace a koncentrace vzorků
Před nanesením vzorku na elektroforézní gel je důležité, aby rozpouštědlo neobsahovalo nadměrnou koncentraci solí nebo jiných nízkomolekulárních kontaminantů. Vysoký obsah solí ve vzorcích může způsobit nekonzistentní a nepředvídatelnou migraci proteinů. Odsolení lze dosáhnout v jediném kroku na základě filtrace gelu a současného převedení vzorku do požadovaného pufru. Postupy odsolování a výměny pufru však často vedou k ředění vzorku. V aplikacích elektroforézy je pro dosažení dobrých výsledků zapotřebí poměrně vysoká koncentrace vzorku, a proto může být nezbytné vzorek koncentrovat. Vzorek lze účinně a snadno zkoncentrovat pomocí membránové ultrafiltrace.
Některé produkty pro odsolování a koncentrování dodávané společností Cytiva jsou shrnuty v Tabulce 5.
Stanovení celkové koncentrace bílkovin
Při porovnávání množství bílkovin ze vzorků v různých drahách v rámci jednoho gelu nebo mezi gely je velmi důležité, aby všechny dráhy byly zatíženy stejným celkovým množstvím bílkovin. Dvojnásobné zvýšení hladiny exprese určitého proteinu v jedné dráze bude zcela zamaskováno, pokud srovnávací dráha obsahuje dvojnásobné množství celkového proteinu (nebo se dokonce bude zdát, že je exprese snížena, pokud srovnávací dráha obsahuje více než dvojnásobné množství).
K určení koncentrace proteinu v roztoku se běžně používá několik spektrofotometrických metod (3). Patří mezi ně měření vlastní ultrafialové (UV) absorbance proteinu a také metody založené na změně barvy v závislosti na proteinu, jako je klasický Lowryho test založený na mědi (4), Smithův měďnatý/bicinchoninový test (BCA) (5) a Bradfordův test s barvivem (6). Ačkoli jsou tyto postupy široce používány, žádný z nich není zvlášť pohodlný.
Například UV absorbance vyžaduje přístup k čistému proteinu se známým extinkčním koeficientem v roztoku bez rušivých (UV absorbujících) látek. Přibližnou koncentraci proteinu v roztoku (za předpokladu použití kyvety s délkou dráhy 1 cm) lze odhadnout pomocí jedné z následujících rovnic;
A280 = 1 A1 (ml/cm mg) × [Conc.] (mg/ml) × 1 (cm)
A205 = 31 A1 (mL/cm mg) × [Conc.] (mg/ml) × 1 (cm)
1 A280 představuje světlo absorbované bílkovinami při vlnové délce 280 nm, především v důsledku přítomnosti kroužkovaných aminokyselin tyrosinu a tryptofanu. A205 představuje světlo absorbované bílkovinami při vlnové délce 205 nm, což je především důsledek peptidových vazeb mezi aminokyselinami.
Různé bílkoviny však mají velmi rozdílné extinkční koeficienty jak při 280, tak při 205 nm a takto získané odhady koncentrace jsou přinejlepším hrubým odhadem. UV absorbance vyžaduje, aby roztok proteinu neobsahoval jiné látky absorbující UV záření, jako jsou nukleové kyseliny, a aby se měření provádělo pomocí křemenné kyvety.
Měděné/BCA testy jsou založeny na redukci Cu2+ na Cu+ amidy. Ačkoli jsou tyto testy poměrně přesné, vyžadují čerstvě připravené roztoky činidel, které se musí během testu pečlivě odměřovat a míchat. Poté následuje dlouhá, přesně načasovaná inkubace při přísně kontrolovaných zvýšených teplotách a následně okamžité měření absorbance. Oba testy mohou být ovlivněny dalšími látkami často přítomnými v biochemických roztocích, včetně detergentů, lipidů, pufrů a redukčních činidel (3). To vyžaduje, aby testy zahrnovaly také sérii standardních roztoků, z nichž každý má jinou, známou koncentraci bílkovin, ale jinak má stejné složení jako roztoky vzorků.
Bradfordův test je založen na rovnováze mezi třemi formami barviva Coomassie Blue G. V případě, že se jedná o roztok s jinou koncentrací bílkovin, je nutné, aby byl roztok s jinou koncentrací bílkovin, než je koncentrace bílkovin, a aby byl roztok s jinou koncentrací bílkovin. Za silně kyselých podmínek je barvivo nejstabilnější ve své dvojnásobně protonované formě (červené). Po navázání na bílkovinu je však nejstabilnější v neprotonované formě (modrá).
V porovnání s ostatními výše popsanými testy je Bradfordův test s barvivem rychlejší, zahrnuje méně kroků míchání, nevyžaduje zahřívání a poskytuje stabilnější kolorimetrickou odpověď. Test je však náchylný k ovlivnění nebílkovinnými zdroji, zejména detergenty, a na horní hranici použitelného rozsahu koncentrace bílkovin se stává postupně méně lineárním. Odezva se také mění v závislosti na struktuře proteinu. Kvůli těmto omezením je nutné při tomto testu používat standardní roztoky bílkovin.
Bradfordovo barvivo reaguje především se zbytky argininu a v menší míře se zbytky histidinu, lysinu, tyrosinu, tryptofanu a fenylalaninu. Test je tedy méně přesný pro bazické nebo kyselé bílkoviny a je citlivější na hovězí sérový albumin než na "průměrné" bílkoviny, a to přibližně dvojnásobně. IgG je preferovaným proteinovým standardem pro Bradfordovu barvicí analýzu.
Přístroje pro stanovení celkové koncentrace bílkovin
Používání UV/viditelných spektrofotometrů je v analýze bílkovin velmi rozšířené. Například řada spektrofotometrů Ultrospec™ od společnosti Cytiva nabízí moduly pro stanovení bílkovin, kinetiku enzymové aktivity, kvantifikaci DNA a RNA a analýzu frakcí. Tyto jednotky jsou kompatibilní s tradičními metodami stanovení proteinů popsanými výše. Přístroje jsou vybaveny osmipolohovým měničem vzorků a jsou optimální pro stanovení koncentrace bílkovin pomocí sady 2-D Quant Kit.
Viditelný spektrofotometr Novaspec™ Plus má navíc uložené metody pro stanovení koncentrace bílkovin pomocí Bradfordova barvicího testu, BCA, Biuretova a Lowryho testu a také základní režimy absorbance, transmitance, OD600 a koncentrace.
2-D Quant Kit lze navzdory jeho názvu použít v mnoha různých aplikacích včetně přesného stanovení koncentrace bílkovin ve vzorcích. Postup funguje na základě kvantitativního vysrážení proteinů, přičemž rušivé látky zůstávají za nimi. Test je založen na specifické vazbě měďnatých iontů na polypeptidovou páteř jakéhokoli přítomného proteinu. Vysrážené bílkoviny se resuspendují v roztoku obsahujícím měď a nenavázaná měď se měří kolorimetrickým činidlem. Absorbance při 480 nm je nepřímo úměrná koncentraci bílkovin. Test má lineární odezvu na koncentrace bílkovin v rozmezí 0 až 50 μg/ml při použití doporučeného objemu vzorku 1 až 50 μl. Kromě toho je souprava 2-D Quant Kit kompatibilní s většinou činidel používaných v mnoha popsaných technikách přípravy vzorků, jako je například SDS.

**Ochranná známka třetí strany
Materiály
Odkazy
Abyste mohli pokračovat ve čtení, přihlaste se nebo vytvořte účet.
Nemáte účet?