Fáze I-II

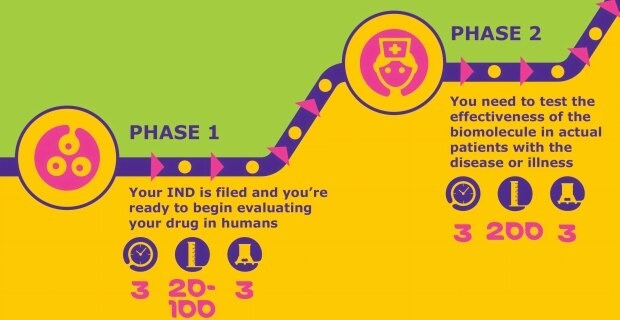
Po přijetí žádosti o zkoušený nový léčivý přípravek (IND) lze zahájit fázi I klinických hodnocení. Během této vývojové fáze bude kandidát na léčivo testován na zdravých jedincích z hlediska bezpečnosti.
Teď je čas na vývoj, standardizaci a rozšíření výrobních kapacit pro léčiva a zajištění správných analytických a kontrolních procesů kvality, které jsou standardizovány kapacitně
Po zjištění bezpečnosti kandidáta na léčivo budou zkoušky fáze II hodnotit účinnost. Úspěch v této fázi může vést k zájmu partnerů a investorů. V této fázi se pozornost soustředí na zvětšování a další optimalizaci procesů a zajištění vyhovující úrovně endotoxinů a sterility.
Doporučené kategorie
Naše systémy hotových buněčných linií připravené k použití výrazně snižují čas, náklady a riziko vývoje nových buněčných linií pro výrobu. Ať už vyrábíte protilátky, rekombinantní proteiny, vakcíny nebo virové vektory pro genové terapie, naše platformy buněčných linií mohou urychlit váš postup proti proudu.
Vývoj a implementace procesu v klinickém měřítku může být časově náročná a složitá, protože vyžaduje specifikaci, zajištění a integraci mnoha komponent. Pomocí šablony pro klinické měřítko můžete rychle vytvořit vlastní kapacity pro výrobu předklinického materiálu, materiálu fáze I a fáze II.
Zjistěte více o šablonových procesech pomocí těchto průvodci aplikací pro biofarmacii pro:
- Vakcíny (včetně mRNA)
- Monoklonální protilátky (mAbs)
- Konjugáty protilátkových léčiv (ADC)
- Mikrobiální
- Plasmidová DNA (pDNA)
- Buněčná a genová terapie (CGT)
Přístup ke správným zdrojům vám pomůže zaměřit se na objevy a klinické kandidáty s největším potenciálem pomoci potřebným pacientům. Chcete-li se dozvědět více, vyberte si fázi vývojového procesu nebo sledujte odkazy na produkty a služby, kde najdete zdroje nabízející možnosti plug-and-play na začátku tvorby vašeho startupu.
Zdroje Biotech Hub Pracovní postup


Discovery
Identifikace aspektů, zdrojů a podpory, které potřebujete k vývoji nového kandidáta na biologické léčivo

Předklinické testy
Zjištění bezpečnosti a účinnosti pro vaši žádost o zkoušku nového léčiva (IND)

Fáze III a výroba
Postup od rozšiřování a převodu technologií ke kvalitativní výrobě pro zkoušky a komercializaci

Spouštěcí programy
Spojení se zdroji a grantovými programy, které mohou uvolnit potenciál vaší molekuly

Právní předpisy
Kontrola jednoho z nejregulovanějších odvětví na světě začíná s důvěryhodným průvodcem
Vyhledejte v našem vyhledávači dokumentů datové listy, certifikáty a technickou dokumentaci.
Biotechnologické zdroje
- Biopharmaceutical Application Guide
Navigate the biopharmaceutical landscape with our application guide, providing resources and solutions for mAb, ADC, and mRNA processes.
- A Molecule’s Journey: Breaking Down Roadblocks to Clinical Success
A guidebook for biopharma executives navigating the complexities of clinical development. Learn how to successfully bring a molecule from the lab to the clinic.
- Quality and Regulatory Trends
Explore how we ensure high-quality products and services with a focus on compliance, risk management, and a strong code of conduct.
- Using a 3L Disposable Bioreactor to Increase Your Throughput Development Capacity
This webinar showcases the efficiency and economy of single-use bioreactors. Discover how using a 3L single-use bioreactor can enhance your throughput development capacity in therapeutic protein process development.
- Biosimilar Upstream Process Development – The Challenges and Promises
Explore the challenges and promises of biosimilar upstream process development. Learn how process changes impact product quality and achieve consistency in manufacturing.
- Mobius Single-Use Bioreactors Scalability: Bench to Clinical Scale
Discover how Mobius® Single-use Bioreactors enhance throughput development capacity, offering scalable solutions from bench to clinical scale.
Jak vám můžeme pomoci
V případě jakýchkoli dotazů odešlete žádost o zákaznickou podporu
nebo se obraťte na náš tým služeb zákazníkům:
Pište custserv@sial.com
nebo volejte na +1 (800) 244-1173
Další podpora
- Kalkulačky a aplikace
Web Toolbox - vědecké výzkumné nástroje a zdroje pro analytickou chemii, vědu o živé přírodě, chemickou syntézu a materiálovou vědu.
- Customer Support Request
Customer support including help with orders, products, accounts, and website technical issues.
- FAQ
Explore our Frequently Asked Questions for answers to commonly asked questions about our products and services.
Abyste mohli pokračovat ve čtení, přihlaste se nebo vytvořte účet.
Nemáte účet?
