Předklinické testy

Předklinickým testováním se zjišťuje, zda cílová sloučenina vykazuje bezpečnost a účinnost, které jsou nezbytné pro postup do testování na lidech. V této fázi může testování in vitro a in vivo trvat několik let a v případě úspěchu vede k přípravě a podání žádosti o vydání nového zkoumaného léčiva (IND).
Doporučené kategorie
Prohlédněte si naše produkty pro výrobu buněčných kultur, včetně našich médií pro buněčné kultury, přísad a doplňků pro buněčné kultury, bioreaktorů a čisticích filtrů.
Prozkoumejte naše řešení pro přípravu pufrů a médií pro procesní roztoky, včetně řešení Mobius® pro míchání na jedno použití a řešení Mobius® FlexReady.
Zjednodušte svůj pracovní postup při bioprocesu: Prozkoumejte naši nabídku chromatografie pro efektivní purifikaci. Pryskyřice, membrány, kolony a systémy pro každou škálu.
Služby toxikologického testování jsou velmi důležité. Vyžaduje se široké spektrum in vitro a in vivo toxikologických zkoušek, které musí být navrženy v souladu s mezinárodními pokyny a prováděny v plném souladu s předpisy správné laboratorní praxe (SLP).
Úvahy o vývoji procesu
- Vývoj buněčných linií
- Výběr klonů
- Screening médií a krmiv
- Vývoj procesů na začátku procesu
- Založení hlavní buněčné banky
- Vývoj downstream procesů
- Vývoj formulací
- Vývoj a optimalizace analytických metod
- Podpora vývoje analytických procesů
- Analytické programy pro srovnatelnost biosimilars
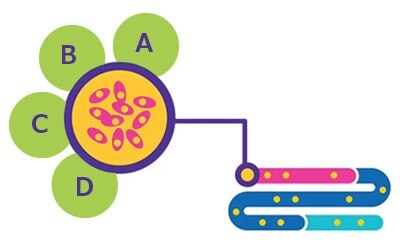
Figure 1.Cell Line Development. A. BioReliance® Product Characterization. B. BioReliance® Cell Banking & Storage. C. BioReliance® Cell Line Development. D. BioReliance® Cell Line Characterization.
Úvahy o vývoji buněčných linií
- Výběr klonu - buněčné linie, které mohou produkovat biologikum v dostatečném titru a kvalitě
- .Studie robustnosti - studie, které replikují podmínky rozšiřování
- Genetická stabilita - produkce a kvalita bílkovin by měla zůstat stabilní po >60 generacích buněk
- Studie robustnosti/li>
Úvahy o vývoji procesu
- Účinnost procesu - eliminace zbytečných kroků a využití kapacity
- Životaschopnost procesu - reprodukovatelnost prostřednictvím rozšiřování a přenosu technologií
- Finanční životaschopnost - vyvážení produktivity a nákladů

Technologické aspekty
- Flexibilita - zařízení na jedno použití zvyšuje flexibilitu, šablonování a rychlou konfiguraci sad a snižuje náklady na čištění./li>
- Škálovatelnost - při výběru technologií v nejranějších fázích, jako je škálování bioreaktoru používaného pro kultivaci savčích buněk ze 3 l na 200 l až 2 000 l
- Snadnost použití - řešení zahrnují předem sestavené sterilní procesní průtokové cesty; konektory, které umožňují aseptické připojení, odpojení a opětovné připojení
Regulační hlediska
- Bezpečnost pacientů - milníky klinického vývoje musí hodnotit bezpečnost a účinnost výrobku
- .Kvalita výrobku a robustnost procesů - je třeba shromáždit a analyzovat údaje, které potvrdí
- Strategie podávání - znalost zemí, kde bude probíhat podávání, by měla být vodítkem pro to, kdo bude kontrolovat výrobní zařízení
Obchodní úvahy
- Rychlost na kliniku - -. do výzkumu a vývoje se vkládají velké investice bez návratnosti
- Efektivita procesu - aktivně zvažte rozšíření, nejen počáteční rychlost
- Strategie podávání žádostí /b> - určete, ve které zemi podat žádost jako první, a rychle získejte přístup na trh
Přístup ke správným zdrojům vám pomůže zaměřit se na objevy s největším potenciálem pomoci potřebným pacientům. Chcete-li se dozvědět více, vyberte si fázi vývojového procesu nebo sledujte odkazy na produkty a služby, kde najdete zdroje.
Vyhledejte v našem vyhledávači dokumentů datové listy, certifikáty a technickou dokumentaci.
Související články
- The production process developed for new drug candidates is governed by a set of requirements. Emerging biotech companies need to understand and apply these regulations. What is GMP versus non-GMP? What does GLP mean and why is it important to the success of the startup? What does the ICH Q7 guide include?
Biotechnologické zdroje
- FDA Investigational New Drug (IND) Application
Explore FDA’s guidance on IND applications, a crucial step in drug development for biotech startups. Navigate regulatory intricacies efficiently.
- Emerging BioTalk Blog
Your gateway to the latest news in biotech. Dive into discussions on market trends, bioprocessing, and technologies for novel modalities. Join the discussion today.
- Brochure: Integrated Bioprocess Solutions
Navigate the path to commercialization with our comprehensive guide for Biopharmaceutical Startups. Accelerate your journey with our range of tools and services.
- Biopharmaceutical Application Guide
Navigate the biopharmaceutical landscape with our application guide, providing resources and solutions for mAb, ADC, and mRNA processes.
Jak vám můžeme pomoci
V případě jakýchkoli dotazů odešlete žádost o zákaznickou podporu
nebo se obraťte na náš tým služeb zákazníkům:
Pište custserv@sial.com
nebo volejte na +1 (800) 244-1173
Další podpora
- Kalkulačky a aplikace
Web Toolbox - vědecké výzkumné nástroje a zdroje pro analytickou chemii, vědu o živé přírodě, chemickou syntézu a materiálovou vědu.
- Customer Support Request
Customer support including help with orders, products, accounts, and website technical issues.
- FAQ
Explore our Frequently Asked Questions for answers to commonly asked questions about our products and services.
Zdroje Biotech Hub Pracovní postup


Discovery
Identifikace aspektů, zdrojů a podpory, které potřebujete k vývoji nového kandidáta na biologické léčivo

Fáze I-II
Urychlení vývoje procesů pomocí tipů, šablon a průvodců aplikacemi

Fáze III a výroba
Postup od rozšiřování a převodu technologií ke kvalitativní výrobě pro zkoušky a komercializaci

Spouštěcí programy
Spojení se zdroji a grantovými programy, které mohou uvolnit potenciál vaší molekuly

Právní předpisy
Kontrola jednoho z nejregulovanějších odvětví na světě začíná s důvěryhodným průvodcem
Abyste mohli pokračovat ve čtení, přihlaste se nebo vytvořte účet.
Nemáte účet?