Iontové kapaliny pro aplikace skladování energie
John D. Stenger-Smith1, Jennifer A. Irvin2
1Naval Air Warfare Center, Weapons Division, China Lake, CA 93555 , 2Texas State University, San Marcos, TX 78666
Material Matters 2009, 4.4, 103.
Úvod
Iontové kapaliny, nazývané také iontové kapaliny o pokojové teplotě, jsou organické soli, které jsou při pokojové teplotě nebo teplotě blízké pokojové teplotě kapalné. Tyto soli (obrázek 1) jsou předmětem značného zájmu díky své velmi nízké těkavosti a schopnosti rozpouštět širokou škálu sloučenin; tato kombinace vlastností činí iontové kapaliny užitečnými jako "ekologická" rozpouštědla pro energetické aplikace a průmyslové procesy.
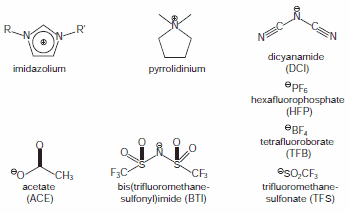
Obrázek 1.Běžné kationty a anionty v iontových kapalinách
Dalším užitečným aspektem některých iontových kapalin je jejich široké okno elektrochemické stability, které může dosahovat až 6,0 V.1 Toto okno činí z těchto iontových kapalin slibné kandidáty pro použití jako elektrolytů pro elektrochemii. Materiály s velkým napěťovým oknem jsou sice žádoucí, ale mohou mít také nepřijatelně vysokou viskozitu a nedostatečnou vodivost pro použití jako elektrolytů. Vysoké viskozity často vedou k vyšším oxidačním potenciálům (v důsledku snížení rychlosti transportu hmoty) a delším reakčním časům.2 Přehled některých iontových kapalných elektrolytů (ILE) uvedených v tabulce 1 rychle odhalí tyto kompromisy.
Oblastí, která zaznamenala významný přínos nástupu ILE, jsou elektroaktivní polymery. Elektroaktivní polymery (EAP) lze obecně přepínat mezi dvěma nebo více stabilními oxidačními stavy, což vede ke změnám vlastností včetně vodivosti, barvy a objemu. Změny barvy vedou k elektrochromním aplikacím, jako jsou displeje a automaticky stmívatelná okna, zatímco změny objemu vedou k aplikacím elektromechanických aktuátorů, jako jsou umělé svaly a mikroelektromechanická zařízení (MEM). Zařízení obsahující EAP byla v posledních třech desetiletích předmětem soustředěného výzkumu. Protože tyto polymery mají možnost přepínání mezi neutrálními formami, oxidovanou formou dopovanou p-typem a redukovanou formou dopovanou n-typem, jsou možné různé konfigurace elektrod. Příkladem je použití elektroaktivních polymerů v elektrochemických kondenzátorech,3 dobíjecích akumulátorech,4 a elektrochromních zařízeních.5 Obrázek 2 ukazuje běžné oxidační a redukční reakce, ke kterým dochází u EAP.
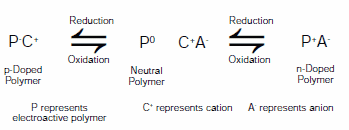
Obrázek 2.Zobecněné reakční schéma pro elektroaktivní polymer (P) přepínající mezi n-dopovaným, neutrálním a p-dopovaným stavem v přítomnosti elektrolytu (C+A-)
Jak ukazuje obrázek 2, oxidace, neutralizace a redukce EAP vyžadují pohyb iontů, aby bylo dodrženo zachování náboje. Volba iontů může ovlivnit morfologii, stabilitu a oxidační a redukční potenciály.6 Ionty se zavádějí pomocí roztoků elektrolytů, jako jsou tetraalkylamoniové soli rozpuštěné ve vodě, acetonitrilu nebo propylenkarbonátu (prod. No. 310328). Iontové kapaliny uvedené na obrázku 1 přitahují značnou pozornost jako alternativní elektrolyty pro EAP-systémy. Mohou být použity v čisté formě nebo v kombinaci s dalšími rozpouštědly.7-9 Mezi výhody ILE patří široké teplotní okno použití, nízká těkavost a dobrá elektrochemická a tepelná stabilita.10 Při použití bez dalších rozpouštědel elektrolyty v iontové kapalině výrazně zlepšují spínací stabilitu zařízení na bázi EAP oproti elektrolytům na bázi roztoku.11
Použití iontových kapalin v superkondenzátorech a bateriích
Elektrochemické kondenzátory (superkondenzátory)
Elektrochemické kondenzátory (EC), známé také jako superkondenzátory, jsou zařízení pro ukládání náboje s vyrovnáváním výkonu, v nichž se k ukládání elektrické energie využívá oxidace a redukce elektroaktivních polymerů, oxidů kovů nebo uhlíkatých materiálů. V procesu nabíjení se elektrody EC redukují (katoda) a oxidují (anoda), aby se uložila elektrická energie, která se pak uvolňuje při vybíjení, kdy se elektrodové materiály vracejí do neutrálního stavu. Obrázek 3 znázorňuje zobecněné fungování EC typu IV, který kombinuje p-dopované (anoda) a n-dopované (katoda) polymery pro maximální ukládání energie.
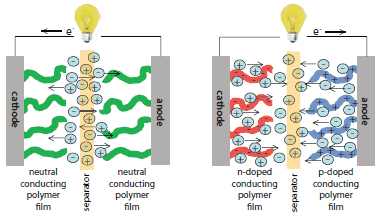
Obrázek 3.Schéma elektrochemického kondenzátoru na bázi elektroaktivního polymeru zobrazující tok elektronů a pohyb iontů během nabíjení (vlevo) a vybíjení (vpravo). Během nabíjení se polymer na katodě (dopovaný n) nabíjí záporně a kationty z elektrolytu se pohybují, aby náboj vyrovnaly. Současně se polymer na anodě (p-dopovaný) nabíjí kladně a anionty z elektrolytu se přesouvají, aby náboj vyrovnaly. Během vybíjení se oba polymery vrátí do neutrálního stavu a ionty se vrátí do roztoku.
Mezi nejvýznamnější aplikace EC patří systémy ochrany paměti pro přenosnou elektroniku, vyrovnávání zátěže pro elektrické podniky a ukládání energie pro elektromobily. EC obecně poskytují větší výkon na jednotku hmotnosti než baterie a uchovávají více energie na jednotku hmotnosti než tradiční kondenzátory. Proto mohou být použity k dodávce energie pro elektrická vozidla. Všechny EC vyžadují ke svému provozu elektrolyt; použití iontových kapalin7,12 umožňuje eliminovat těkavá a nebezpečná konvenční rozpouštědla a zlepšuje provozní stabilitu těchto zařízení.
Lithium-iontové baterie
Lithium-iontové baterie jsou všudypřítomné na trhu se spotřební elektronikou a nakonec mohou převládnout ve velkých komerčních úložištích energie s vysokým výkonem. Lithiové baterie se skládají ze dvou lithium-interkalujících oxidových a uhlíkových elektrod oddělených elektrolytem (obrázek 4). Při nabíjení baterie se ionty lithia přesouvají z oxidové elektrody na uhlíkovou a ukládají energii. Při vybíjení baterie se ionty lithia přesunou zpět na oxid a energie se uvolní. Přenos iontů lithia usnadňuje elektrolyt, který obvykle obsahuje těkavé a hořlavé rozpouštědlo. Proto je u baterií obsahujících běžné elektrolyty hlavním problémem bezpečnost. Zkraty nebo lokální přehřátí v přítomnosti hořlavých rozpouštědel mohou způsobit tepelný únik, požár, a dokonce i výbuch. Iontové kapaliny mohou být užitečné zejména v lithium-iontových bateriích, protože nahrazují hořlavá rozpouštědla a zvyšují bezpečnost baterií.10
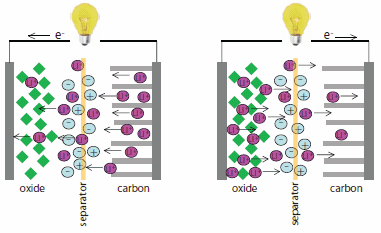
Obrázek 4.Lithium-iontová baterie zobrazující tok elektronů a pohyb iontů lithia během vybíjení (vlevo) a nabíjení (vpravo).
Na rozdíl od elektrolytů elektrochemických kondenzátorů musí navíc elektrolyty lithiových baterií usnadňovat transport iontů lithia, zůstat stabilní při velmi záporných potenciálech a podporovat stabilní provoz baterie. Je možné, aby iontové kapaliny tento požadavek splňovaly, a v této oblasti pracuje několik výzkumných skupin.10,13 Mezi testované iontové kapaliny patří N-butyl-N-ethyl pyrrolidinium bis(trifluormethylsulfonylimid) (prod. č. 38894); ethylmethylimidazolium bis(trifluormethylsulfonylimid) (prod. č. 38894); ethylmethylimidazolium bis(trifluormethylsulfonylimid) (prod. č. 38894); N-butyl-N-ethyl pyrrolidinium bis(trifluormethylsulfonylimid) (prod. No. 711691); N-methyl-N-propyl pyrrolidinium bis(trifluormethylsulfonylimid) a N-methyl-N-propyl piperidinium bis(trifluormethylsulfonylimid). Kterýkoli z nich lze použít k přípravě roztoků lithného bis(trifluormetansulfonylimidu) (prod. č. 544094), kde je aktivním materiálem lithný ion.
Iontové kapaliny při extrémních teplotách
S rostoucím důrazem na výrobu a skladování energie roste poptávka po zařízeních pro skladování náboje, která pracují při nejrůznějších teplotách. V automobilovém průmyslu by zařízení pro ukládání nábojů měla být v ideálním případě funkční při teplotách až -30 °C.14 Vojenské požadavky na zařízení pro ukládání nábojů jsou ještě přísnější a pro některé aplikace jsou cílové teploty až -60 °C.15 Většina baterií trpí při nižších teplotách, zejména do -60 °C, silnou degradací výkonu.16 Kromě zpomalení kinetiky procesu nabíjení/vybíjení se při nižších teplotách také zvyšuje viskozita elektrolytů, což snižuje schopnost elektrolytu transportovat náboj. Tyto změny vlastností vedou ke zhoršení výkonu zařízení nebo k jeho selhání při delším vystavení nízkým teplotám. Jedním z nejzávažnějších účinků nízkých teplot na elektrolyty na bázi roztoku je snížená rozpustnost materiálu elektrolytu, což vede k vysrážení soli a zničení elektrochemického kondenzátoru nebo baterie. Jak je patrné z tabulky 1, mnoho iontových kapalných elektrolytů je funkčních při středně nízkých teplotách požadovaných v automobilovém průmyslu, ale jen velmi málo z nich bude fungovat při extrémně nízkých teplotách požadovaných pro vojenské aplikace.17 K tomu přistupuje skutečnost, že tyto elektrolyty by měly podporovat elektrochemické procesy (depozice, oxidace, redukce, provoz zařízení,15 atd.) v různých monomerních/polymerních systémech ve stejném širokém teplotním intervalu. Bohužel existuje pouze několik ILE, které zůstávají kapalné při extrémně nízkých teplotách, a jejich viskozita může být pro většinu elektrochemických aplikací neúnosně vysoká. Tento problém by mohly pomoci zmírnit směsi různých iontových kapalin nebo použití přísad snižujících viskozitu. V odvětví skladování energie se také řeší výkonnost elektrochemických zařízení při zvýšených teplotách až do 60 °C.14 Bohužel většina elektrolytů na bázi rozpouštědel trpí vysokou těkavostí rozpouštědel při zvýšených teplotách. Odpařování rozpouštědel může mít v uzavřených systémech za následek požár a výbuch, zatímco v otevřených systémech může vést ke srážení elektrolytu, zničení materiálů pro ukládání náboje a ztrátě schopnosti ukládat náboj. Extrémně nízká těkavost iontových kapalin z nich tedy činí vynikající elektrolyty pro použití při zvýšených teplotách.
Další aplikace
Existuje mnoho dalších aplikací, pro které mají iontové kapaliny potenciál. Široká elektrochemická okna a nízké tlaky par je činí výhodnými pro galvanické pokovování kovů a polovodičů.18 Iontové kapaliny jsou také slibnou technologií pro vysokoteplotní palivové články.19 Při teplotách vyšších než 100 °C, kdy voda jako rozpouštědlo nepřichází v úvahu, představují iontové kapaliny vynikající alternativu ke konvenčním vodným systémům pro přenos protonů. Elektromechanické aktuátory využívající elektroaktivní nebo iontově výměnné polymery vyžadují elektrolyt pro usnadnění aktivace; bylo prokázáno, že iontové kapaliny zvyšují dlouhodobou stabilitu těchto zařízení.20 Snad nejvýznamnějším příkladem zvýšení stability pomocí iontových kapalin jsou elektrochromní zařízení, u nichž nebylo možné pozorovat žádnou významnou ztrátu elektroaktivity po 1 000 000 cyklech, když byl použit 1-butyl-3-methyl imidazolium tetrafluoroborát (prod. No. 711748) byl použit jako elektrolyt v elektrochromním displeji na bázi polyanilinu.10
Požadavky na čistotu
Čistota elektrolytů používaných v aplikacích pro skladování energie je rozhodující pro stabilitu a výkon elektrochemických zařízení. Iontové kapaliny nejsou výjimkou. V závislosti na syntetických postupech používaných pro přípravu iontových kapalin mohou nečistoty v těchto materiálech obsahovat vodu, nadbytečné kationty nebo anionty nebo jiná rozpouštědla. I stopové množství nečistot může vést k nežádoucím vedlejším reakcím a omezit výkon zařízení na bázi EAP. Tak bylo prokázáno, že nečistoty chloridů a vody ovlivňují viskozitu iontových kapalin.21, 22 Malá množství (několik ppm) sorbentů, jako je oxid hlinitý a oxid křemičitý, mohou mít rovněž za následek jejich sníženou elektrochemickou výkonnost.23 Purifikační přístupy, při nichž vznikají iontové kapaliny vhodné pro použití v elektrochemii, často zahrnují sloupcovou chromatografii nebo vakuovou destilaci (k odstranění těkavých nečistot; samotné iontové kapaliny se nedestilují). Byly publikovány pro mnoho běžných materiálů a měly by být pečlivě dodržovány.21-23
Shrnutí a závěry
Velmi nízká těkavost a dobrá elektrochemická stabilita mnoha iontových kapalin z nich činí vynikající volbu pro použití jako elektrolytů v zařízeních pro ukládání energie. Pro elektrochemické aplikace se doporučuje přísné čištění. V zařízeních využívajících iontové kapalné elektrolyty je pozorována vynikající elektrochemická stabilita. Jedinečnou vlastností iontových kapalných elektrolytů je jejich schopnost pracovat při extrémních teplotách, což z nich činí slibné kandidáty pro použití v elektromobilech a mnoha dalších aplikacích.
Poděkování
J. Stenger-Smith děkuje za podporu Úřadu pro námořní výzkum (zejména doktorům M. Andersonovi, P. Armisteadovi a R. Carlinovi) a kanceláři Power Sources Strategic Technology Initiative. J. Irvin děkuje za podporu Úřadu pro námořní výzkum, fondu ACS Petroleum Research Fund a nadaci Welch Foundation. Autoři děkují panu Andrew P. Chafinovi, Dr. Davidu J. Irvinovi, Dr. Andrew Guenthnerovi a Dr. Mariem Rosario-Canalesovi za užitečné diskuse.
Prezentované názory jsou názory autorů a nemusí nutně vyjadřovat názory ministerstva obrany nebo jeho složek.
Materiály
Odkazy
Abyste mohli pokračovat ve čtení, přihlaste se nebo vytvořte účet.
Nemáte účet?