Iontové kapaliny pro dobíjecí baterie
Meng-Chang Lin1,2, Hui Chen2, Hongjie Dai3
1AB Systems Inc., 2458 Embarcadero Way, Palo Alto, California 94303, USA, 2College of Electronic Engineering and Automation, Shandong University of Science and Technology, 266590, Qingdao, China, 3Department of Chemistry, Stanford University, Stanford, California 94305, USA
Material Matters, 2018, 13.1
Úvod
Iontové kapaliny o pokojové teplotě (RTIL) jsou roztavené soli s teplotou tání výrazně nižší než 100 °C. Většina RTIL jsou organické soli s vysokou mírou variability, kterou lze řídit molekulárním designem. Iontové kapaliny (IL) mají mnoho užitečných vlastností, včetně nízkého tlaku par, širokého teplotního okna kapalného stavu, vysoké chemické a tepelné stability, širokého okna elektrochemického napětí, nehořlavosti, vysoké iontové vodivosti a dobré rozpustnosti v různých organických nebo anorganických materiálech.1 Jedinečné vlastnosti IL z nich činí obzvláště slibné kandidáty na (1) ekologicky šetrné nebo "zelené" alternativy organických rozpouštědel pro chemickou syntézu, katalýzu, separaci a extrakci, (2) univerzální elektrolyty pro elektrochemii a fotovoltaiku a (3) nové funkční materiály pro mazání, mikrofluidiku, pohonné látky a senzory.1
V posledních letech vzbudilo velký zájem potenciální využití IL jako nových elektrolytů pro různé sekundární, dobíjecí baterie. ILs byly použity k urychlení vývoje baterií na bázi hliníku,2-9 snížení hořlavosti baterií na bázi lithia,10-13 a zvýšení cyklické stability a coulombické účinnosti duálních grafitových baterií.14-16 Hliníkové anody jsou levné, mají nízkou hořlavost a jedinečné tříelektronové redoxní vlastnosti. V důsledku toho slibují dobíjecí hliníkové baterie úsporu nákladů a vyšší bezpečnost, což by mohlo vést novým směrem pro technologie skladování energie.2 IL jsou ideální elektrolyty pro vývoj Al baterií, které se vyhýbají problému pasivace hydroxidu hlinitého na povrchu Al ve vodných elektrolytech. Pro použití v Al bateriích v elektrolytech IL bylo studováno několik katodových materiálů, včetně grafitu2-6 a oxidů přechodných kovů7-9 . Na druhé straně sekundární baterie na bázi lithia, které se skládají z grafitových nebo čistě lithiových anod a elektrolytů s organickými rozpouštědly, mají potenciál pro vysoká provozní napětí, vysokou hustotu energie a dobrou cyklickou stabilitu, ale jejich nevýhodou jsou hořlavé elektrolyty, které mohou vést k bezpečnostním rizikům.10-13 IL byly v průběhu let rovněž studovány za účelem zvýšení bezpečnosti lithium-iontových baterií. Duální grafitové baterie, které využívají levný grafit pro anodu i katodu a používají nehořlavé iontové kapalné elektrolyty, by mohly vést k přínosům pro životní prostředí, zvýšení bezpečnosti a úspoře nákladů.14-16
Předkládáme zde stručný přehled iontových kapalných elektrolytů používaných v nejmodernějších dobíjecích bateriích, včetně vysoce výkonných a levných hliníkových baterií, nehořlavých baterií na bázi Li a vysoce cyklických a stabilních duálních grafitových baterií. Uvádíme také klíčové zkoumané otázky, abychom určili budoucí směr vývoje IL. Dále se zabýváme tím, jak může všestrannost iontových kapalných elektrolytů podpořit vývoj dobíjecích baterií pro skladování energie.
Syntéza iontových kapalin
IL se skládají z objemných a asymetrických kationtů, jako jsou imidazol, pyrrolidinium, pyridinium, piperidinium, amonim, a fosfonium, a různých anorganických nebo organických aniontů, včetně halogenidů (chlorid [Cl<-], bromid [Br-], jodid [I-]), acetát [AcO-], tetrafluoroboritan [BF4 -], hexafluorofosforečnan [PF6 -], tetrachlorohlinitan [AlCl4 -], bis(trifluorometansulfonyl) imid [TFSI-], ethylsulfát [EtSO4 -], dikyanamid [N(CN)2 -] a thiokyanatanu [SCN-].1 Obrázek 1 ukazuje molekulární strukturu kationtů a aniontů několika iontových kapalin o pokojové teplotě, které se běžně používají pro dobíjecí baterie.

Obrázek 1. Schematické znázornění molekulární struktury kationtů a aniontů z iontových kapalin o pokojové teplotě, které se běžně používají pro dobíjecí baterie. A) Imidazolový kationt, B) Pyrolidiniový kationt, C) Piperidiniový kationt, D) amonný kationt, E) hexafluorofosfátový aniont, F) dikyanamidový aniont, G) tetrachlorhlinitý aniont a H) bis(trifluormethan)sulfonamidový aniont.
IL lze ve většině případů připravit syntetickými postupy pomocí jednostupňových nebo dvoustupňových metod. Například lze získat imidazoliumhalogenidovou sůl jednoduchou alkylací 1-methylimidazolu (kat. č. M50834) alkylhalogenidem (halogenidové anionty (X-): Cl-, Br- nebo I- atd.) (Obrázek 2). Vzniklé imidazoliumhalogenidové soli lze použít přímo jako IL nebo k výrobě imidazoliové soli s požadovaným aniontem v následné metatezi. Nejprve se smísí imidazoliumhalidová sůl s M+A- kovovou solí (M+: Ag+, Na+ nebo K+ atd.; A-: BF4-, PF6-, TFSI- atd.). Poté se halogenidový aniont nahradí požadovaným A- aniontem, čímž se získá imidazolová A- sůl. V některých případech je však obtížné získat metatezí kovových solí vysoce čisté iontové kapaliny, protože M+X- (jako nečistota) je v IL rozpustný. Přítomnost zbytkových kontaminací halogenidů v ILs může ovlivnit fyzikální vlastnosti.17
Alternativně lze vysoce čisté ILs získat postupem bez použití kovových solí.18 Například 1-alkan-3-methylimidazolium methylkarbonátové soli lze připravit alkylací 1-alkanimidazolu uhličitanem při 210 °C v autoklávu s PTFE povlakem po dobu více než 2 hodin. IL lze získat další neutralizací roztoků kyselinou, přičemž vedlejšími produkty jsou nerozpustný methanol a plynný CO2. Nerozpustné vedlejší produkty se snadno odstraní vakuováním a zahříváním.

Obrázek 2. Syntéza A) solí na bázi imidazolu alkylací 1-methylimidazolu alkylhalogenidem a získané halogenidové soli se použijí k metatezi se solemi kovů za účelem získání imidazolové soli s žádoucím aniontem. B) 1-Ethyl-3-methylimidazoliumacetát (kat. č. 689483) za použití dimethylkarbonátu jako alkylačního činidla a poté neutralizací roztoku kyselinou. Nerozpustné vedlejší produkty lze snadno odstranit pomocí vakua a zahřívání.
Baterie na bázi hliníku s iontovým kapalným elektrolytem
Studie2-9 ukázaly, že imidazolové soli (např. [EMIm] Cl) nebo amidové ligandy (např. močovina) lze použít k vytvoření iontových kapalných elektrolytů nebo elektrolytů s hlubokým eutektickým rozpouštědlem (kvazi iontová kapalina) pro dobíjecí hliníkové baterie. Smícháním s AlCl3 obsahují tyto elektrolyty redoxně aktivní chlorohlinitanové anionty (jako je AlCl4 -. a Al2Cl7-) a [AlCl2-(ligand)n]+ kationty.
Na konci 80. let Gifford a spol.2 představili hliníkovo-chlorový dobíjecí článek, který využíval Al anodu a grafitovou katodovou elektrodu s elektrolytem AlCl3/1,2-dimethyl-3-propylimidazolium chlorid. Grafitová katodová elektroda hrála roli reverzibilní interkalační elektrody pro chlor. Článek měl průměrné vybíjecí napětí 1,7 V a maximální kapacitu pro ukládání náboje 35 mAh g-1 vzhledem k hmotnosti grafitu. Bylo však zjištěno, že téměř 85 % kapacity se po více než 100 cyklech rozpadlo v důsledku rozpadu grafitové elektrody. V roce 2015 jsme představili ultrarychlou dobíjecí hliníko-iontovou baterii s elektrolytem AlCl3/1-ethyl-3-methylimidazolium chlorid (AlCl3/[EMIm]Cl).3 Baterie vykazovala dobře definované plato vybíjecího napětí v blízkosti 2 V, specifickou kapacitu přibližně 70 mAh g-1 a Coulombovu účinnost téměř 98 %. Byla nalezena nová trojrozměrná grafitová pěnová katoda, která umožňovala rychlou difúzi aniontů a interkalaci, což umožňovalo dobu nabíjení 1 minutu při vysokých proudových hustotách 4 000 mA g-1 (3 000 W kg-1). Všechny tyto vlastnosti umožnily zařízení vydržet téměř 7 500 cyklů bez poklesu kapacity (obrázek 3). Poté jsme publikovali další práce, ve kterých jsme jako katodový materiál použili přírodní grafitové vločky.5,6 Katoda z přírodních grafitových vloček5 vykazovala vynikající elektrochemické vlastnosti v elektrolytu AlCl3/[EMIm]Cl. Například článek dosáhl měrné kapacity 110 mAh g-1 s coulombickou účinností téměř 98 % při proudové hustotě 99 mA g-1 (0.9 C) a zřetelnými plošinami vybíjecího napětí (2,25-2,0 V a 1,9-1,5 V).
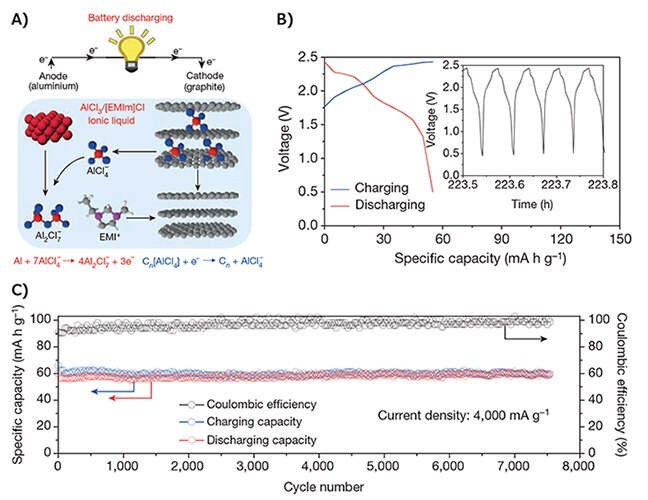
Obrázek 3. A) Schematický nákres Al/grafitového článku během vybíjení s použitím optimálního složení iontového kapalného elektrolytu AlCl3/[EMIm]Cl. Na anodové straně se kovový Al a AlCl4- během vybíjení přeměňovaly na Al2Cl7- a během nabíjení probíhala opačná reakce. Na straně katody docházelo během nabíjecí, resp. vybíjecí reakce k interkalaci a deinterkalaci převážně AlCl4- mezi vrstvami grafitu. B) Galvanostatické nabíjecí a vybíjecí křivky Al/grafitovo-pěnového váčkového článku při proudové hustotě 4 000 mA g-1. C) Test dlouhodobé stability Al/grafitovo-pěnového váčkového článku v průběhu 7 500 nabíjecích a vybíjecích cyklů při proudové hustotě 4 000 mA g-1. Reprodukováno se souhlasem z odkazu 3, copyright 2015 Nature Publishing Group.
Vyvinuli jsme také Al-iontovou baterii s vysokou coulombickou účinností (~99,7 %) s použitím hliníku jako anody, grafitu jako katody a levného analogického iontového kapalného elektrolytu vyrobeného ze směsi AlCl3 a močoviny v molárním poměru 1,3:1.6 Baterie vykazovala vybíjecí napěťové plato kolem 1,9 a 1,5 V (průměrné vybíjení: 1.73 V) a poskytovala specifickou kapacitu katody ~73 mAh g-1 při proudové hustotě 100 mA g-1 (~1,4 C). Není obtížné dosáhnout tak vysoké coulombické účinnosti v rozsahu rychlostí nabíjení nebo vybíjení se stabilitou po dobu ~150-200 cyklů. Problémem je však ~10krát vyšší viskozita a nižší iontová vodivost elektrolytů na bázi močoviny (jako je AlCl3/urea: 1,3 (v molárním poměru) ~1,23 mS cm-1 při 25 °C než u AlCl3/EMImCl), snižuje schopnost hliníkových baterií na bázi močoviny dosahovat rychlosti C. V případě, že se jedná o baterie na bázi močoviny, je třeba počítat s vyšší vodivostí.
V baterii Al anoda/grafitová katoda lze zjednodušené redoxní reakce Al/grafitového článku během nabíjení a vybíjení zapsat takto:3

Rovnice 1 a 2.redoxní reakce Al/grafitového článku během nabíjení a vybíjení
kde n označuje molární poměr atomů uhlíku a interkalovaných aniontů v grafitu. Vyvážený AlCl4- a Al2Cl7-<./sup> koncentrace v elektrolytu zajistily optimální nabíjecí kapacitu na katodě, přičemž hojné množství AlCl4- pro nabíjení nebo interkalaci do grafitu (jak je znázorněno v rovnici 1) a dostatečným množstvím Al2ClClsub>7- pro nabíjení nebo elektrodepozici Al v anodě (jak je uvedeno v rovnici 2). Pro případ elektrolytu na bázi močoviny se použijí AlCl4-, Al2Cl7-< ./sup> anionty a [AlCl2-(močovina)n]+ kationty koexistují v elektrolytu AlCl3/močovina. K depozici hliníku může docházet dvěma cestami, které zahrnují anionty (rovnice 2) a kationty (rovnice 3).6

Rovnice 3.Elektrolyt AlCl3/močovina
Kromě grafitu byly jako kandidáti na katodové materiály pro hliníkové iontové baterie navrženy oxidy přechodných kovů7-9 . Archerova skupina7 na Cornellově univerzitě použila nanodrátek pentoxidu vanadičitého (V2O5) jako katodu, Al jako anodu a AlCl3/[EMIm]Cl jako elektrolyt. Následná práce však ukázala, že materiál V2O5 katody je v elektrolytu AlCl3/[EMIm]Cl elektrochemicky neaktivní a jako aktivní elektroda v proudovém kolektoru působí nerezová ocel. Hmotnost aktivního materiálu tedy nebyla známa.19 Navzdory tvrzení, že interkalace a deinterkalace Al3+ ve VO2 katodě (AlCl3/1-butyl-3-methylimidazoliumchloridový elektrolyt) a amorfní V2O5 katodě (AlCl3/dipropylsulfon/toluen) bylo popsáno několika výzkumnými skupinami.9 Podle Browna a spol,8 bylo rovněž ověřeno, že spinel Mn2O4 je použitelnou katodou pro Al-iontové baterie v elektrolytu AlCl3/[EMIm]Cl bez dalších experimentálních podrobností. Pokud jde o katodu z oxidu přechodných kovů7-9 vědci předpokládali, že se Al3+ během vybíjení baterie hromadí na katodě. Poté volný Al3+ migroval do katody a vytvořil interkalované sloučeniny Al (jak je znázorněno v .nbsp;rovnici 4, přičemž jako příklad je použita V2O5 katoda9b)).

Rovnice 4.Al3+ migruje do katody a vytváří interkalované sloučeniny Al.
Baterie na bázi lithia s iontově kapalnými elektrolyty
U baterie na bázi lithia RTIL se očekává vysoká tepelná stabilita. Lombardova skupina10 na Università di Roma oznámila, že přídavek N-butyl-N-methylpyrrolidinium bis(trifluoromethanesulfonyl)imidu (Pyr<.sub>14TFSI) ke komerčnímu elektrolytu na bázi uhličitanů (1M LiPF6 v EC:DMC (LP30)) lze do značné míry zkrátit dobu samozhášivosti směsi elektrolytů při vystavení volnému plameni v plném Li-ion článku (obrázek 4). Sakaebe a spol.11 poukázali na to, že nejslibnějším kandidátem na elektrolyt pro Li baterie je N-methyl-Npropylpiperidinium bis(trifluoromethanesulfonyl)imid (PP13TFSI). Li/LiCoO2 článek v tomto elektrolytu vykazoval vynikající výkon, se stabilní kapacitou LiCoO2 a dobrou coulombickou účinností (>97 % při rychlosti C/10) v průběhu cyklování. Li/LiCoO2 článek lze otevřít hned po posledním nabití na vzduchu a při kontaktu s ohněm nebylo pozorováno žádné vznícení.11
Zkoumala se také cyklická stabilita baterií na bázi Li s různými iontovými kapalnými elektrolyty. Podle Holzapfela a kol,12 když byly kladné elektrody LiCoO2 cyklovány v 1 M roztoku LiPF2 s přídavkem 5 % vinylen-karbonátu.sub>6 v 1-Ethyl-3- methylimidazolium-bis(trifluoromethylsulfonyl)imidu (EMI-TFSI, kat. No. 11291) bylo pozorováno dobré udržení nabíjecí kapacity více než 300 cyklů, když byl jako záporná elektroda použit Li4Ti5O12 . Stabilita čistého elektrolytu na bázi EMI proti redukci se však zdá být v systému lithiových baterií (tj. kov Li jako záporná elektroda) nedostatečná. Elia et al.13 ukázali pokročilou lithium-iontovou baterii s dlouhou životností při použití Pyr14.TFSI-LiTFSI nehořlavý iontový kapalný elektrolyt, nanostrukturovanou anodu z nanokompozitu cínu a uhlíku a vrstvenou LiNi1/3Co1/3Mn1/3O2 katodu. Baterie byla podrobena dlouhodobým cyklům při teplotě 40 °C, přičemž byla zjištěna stabilní kapacita přibližně 140 mAh g-1 a zachování kapacity nad 99 % po více než 400 cyklech.

Obrázek 4. Obrázky hořlavosti LP30 při A) době spuštění, B) po 10 s, C) po 15 s a D) po 20 s, LP30/ Py14TFSI 70/30 hm. při E) době spuštění, F) po 10 s, G) po 15 s a H) po 20 s a LP30/Py14TFSI 50/50 hm. při I) době spuštění, J) po 10 s, K) po 15 s a L) po 20 s. Reprodukováno se svolením z odkazu 10, copyright 2012 Elsevier B.V.
Dvojgrafitové baterie s iontově kapalným elektrolytem
První dvojgrafitovou baterii navrhl Carlin a kol.,14 s použitím různých RTIL, jako je 1-ethyl-3-methylimidazolium tetrachloroaluminát (EMI+AlCl4 -, kat. No. 724424). EMI+ interkaloval do grafitové anody, zatímco AlCl4- interkaloval do grafitové katody během procesu nabíjení. Článek poskytoval vybíjecí napětí 3,15 V. Nicméně reverzibilita interkalace nebo deinterkalačního chování tohoto duálního grafitového článku byla poměrně špatná, což bylo způsobeno nestabilitou EMI+ interkalantu v grafitu.14 Pro duální grafitové baterie jsou nutné zejména elektrolyty s vysokou stabilitou vůči oxidaci, a to z důvodu velmi vysokých provozních potenciálů katody, které mohou přesáhnout 5 V vůči oxidaci. Li/Li+.15 Winterova skupina15 na univerzitě v Mü.nsteru prokázala slibné výsledky s vysokým elektrochemickým výkonem duálního grafitového článku s použitím směsi iontového kapalného elektrolytu Py14TFSI/LiTFSI a ethylsulfitem (ES) jako přísadou tvořící rozhraní pevného elektrolytu (SEI). Článek vykazoval stabilní cyklický výkon po více než 500 cyklech s vybíjecí kapacitou přibližně 50 mAh g-1 při mezním nabíjecím napětí 5,14 V vůči Li/Li+ (obrázek 5). Navíc coulombická účinnost vykazovala průměrnou hodnotu 99,8 %.
Fan a spol.16 uvedli iontově kapalný duální grafitový článek s čistým 1-butyl-1-methylpiperidinium bis(trifluorometylsulfonyl)imidem (PP14TFSI, kat. No. 713074) jako elektrolytem, který poskytuje vysokou vybíjecí plošinu začínající při 4. teplotě.4 V, dobře definovanou kapacitu 82 mAh g-1, velmi široký rozsah potenciálu nabíjení/vybíjení 1,0- 5,0 V a vynikající stabilitu ~100% zachování kapacity po dobu 600 cyklů. Duální grafitové baterie s iontovým kapalným elektrolytem nevykazovaly žádnou hořlavost a mohou si dovolit vysoké vybíjecí napětí (3,0-5,0 V), což přitáhlo pozornost výzkumníků. Iontový kapalný elektrolyt funguje nejen jako nosič náboje, ale také jako zdroj interkalačních hostů pro grafitovou anodu a grafitovou katodu. Navrhované elektrochemické interkalační procesy lze zapsat takto:

Rovnice 5 a 6.Elektrochemické interkalační procesy
kde kationtem může být EMI+, Li+ nebo Na+ a aniontem AlCl4<.sup>-, BF4-, TFSI- nebo PF6-.14-16

Obrázek 5. A)Schematické znázornění dvojitého grafitového článku s účinnou vrstvou SEI na grafitové anodě během procesu nabíjení. Záporná grafitová elektroda je chráněna před kointerkalačními reakcemi pyrrolidiniových kationtů vrstvou SEI; SEI přesto umožňuje transport a interkalaci lithiových iontů. B) Profil napětí článku v závislosti na čase (černá, tečkovaná křivka) a profily anodového a katodového potenciálu v závislosti na čase (červené křivky) duálního grafitového článku CG/KS6L během reprezentativních cyklů cyklického procesu nabíjení/vybíjení konstantním proudem. Specifický proud pro cykly 1-3 je 10 mA g-1 a 50 mA g-1 pro následující cykly. Rozsah napětí článku: 3,0 V a 5,1 V. C) Křivka vybíjecí kapacity a křivka coulombické účinnosti cyklického nabíjení/vybíjení konstantním proudem duálního grafitového článku CG/KS6L. Rozsah napětí článku: 3,0 V a 5,1 V; specifický proud pro nabíjení a vybíjení: 10 mA g-1 (pro cykly 1-3 a 500 mA g-1 (pro cykly 4-500). Reprodukováno se svolením z odkazu 15, copyright 2014 The Royal Society of Chemistry.
Perspektiva
Při použití iontového kapalného elektrolytu AlCl3/EMImCl vykazují hliníkové baterie s grafitovou katodou vynikající cyklickou stabilitu a schopnost dosáhnout rychlosti C. Kromě AlCl3/EMImCl lze jako elektrolyt v hliníkových bateriích použít i levný AlCl3/močovina, což by mohlo výrazně snížit jejich cenu. Vysoká viskozita elektrolytů na bázi močoviny však v současné době omezuje jejich schopnost dosáhnout rychlosti C a měrné kapacity v hliníkových bateriích.
Ačkoli elektrolyty na bázi IL EMIm vykazují mezi IL v lithiových bateriích vysokou vodivost i nízkou viskozitu, nedostatečná cyklická stabilita omezuje jejich využitelnost při použití čistého lithia jako záporné elektrody. Pyrrolidiniové soli byly také smíchány s konvenčním elektrolytem na bázi alkylkarbonátu, aby se zlepšila odolnost proti plameni u baterií na bázi Li. Na druhou stranu baterie na bázi Li využívající čisté iontové kapalné elektrolyty na bázi piperidinia vykazují nízkou hořlavost a dobrou cyklickou stabilitu při použití čisté Li anody. Aby bylo možné konkurovat komerčním lithium-iontovým bateriím, bude hlavní překážkou pro lithiové baterie s elektrolyty na bázi iontové kapaliny dlouhodobá cyklická stabilita (např. zachování 80 % kapacity po 2 000 cyklech).
Například baterie s duálním grafitem a elektrolyty na bázi IL s vysokou vodivostí EMI vykazovaly vysoké samovybíjení, což vedlo k nízké coulombické účinnosti. Jako elektrolyty pro duální grafitové baterie byly použity směsi pyrrolidiniových a TFSI solí s cílem zvýšit cyklickou stabilitu i coulombickou účinnost. Hlavním problémem duálních grafitových baterií s elektrolyty na bázi IL je však stále nízká schopnost C.
Iontové kapaliny vykazují široké okno elektrochemické stability až do 5 V, přičemž není pozorována žádná hořlavost ani při přímém kontaktu s ohněm a relativně vysoká vodivost. To z nich činí slibné elektrolyty pro vysoce výkonné/levné hliníkové baterie, nehořlavé baterie na bázi Li a pro zajištění vysoké cyklické stability v duálních grafitových bateriích. Tyto úspěchy společně naznačují zářnou komerční budoucnost elektrolytů IL v pokročilých bateriích pro skladování energie.
Poděkování
M.-C. L. děkuje za podporu v rámci projektu Taishan Scholar Project čínské provincie Shandong (č. tsqn20161025).
Materiály
Odkazy
Abyste mohli pokračovat ve čtení, přihlaste se nebo vytvořte účet.
Nemáte účet?