Polymerázová řetězová reakce
A Technical Guide to PCR Technologies
Na této stránce
Polymerázová řetězová reakce (PCR)1,2,3 se stala jednou z nejpoužívanějších technik v molekulární biologii. Používá se v aplikacích od základního výzkumu až po vysoce výkonný screening. Přestože se jedná o výkonnou techniku, její všeobecné přijetí a rozmanité spektrum aplikací je způsobeno její zdánlivou jednoduchostí a relativně nízkými náklady. Technika se používá k amplifikaci specifických, cílových fragmentů DNA z malého množství zdrojové DNA nebo RNA (po kroku reverzní transkripce k získání komplementární DNA (cDNA), viz Reverzní transkripce). Jednou z hlavních výhod PCR je, že cílové sekvence lze amplifikovat z jediné kopie výchozího materiálu, i když je templát degradován a kontaminován inhibitory. Byly například provedeny studie na DNA získané ze starověkých egyptských mumií za účelem identifikace členů rodiny krále Tutanchamona4. PCR se dokonce objevuje ve velkofilmech a ve většině televizních kriminálních seriálů v určité fázi "vyšetřování", i když poněkud nadsazeně.
Proces cyklování PCR
Typická PCR se skládá z:
- Počáteční denaturace: Teplota reakce se zvýší na 95 °C a reakce se inkubuje po dobu 2-5 min (až 10 min v závislosti na vlastnostech enzymu a složitosti templátu), aby se zajistilo, že všechny složité dvouřetězcové molekuly DNA (dsDNA) budou rozděleny na jednotlivá vlákna pro amplifikaci.
- Cyklování:
- Denaturace: Teplota reakce se zvýší na 95 °C, čímž dojde k roztavení (narušení vodíkových vazeb mezi komplementárními bázemi) všech dsDNA na jednořetězcovou DNA (ssDNA).
- Zapalování: Teplota se sníží přibližně o 5 °C pod teplotu tání (Tm) primerů (často 45-60 °C), aby se podpořila vazba primerů na templát.
- Extenze: Teplota se zvýší na 72 °C, která je optimální pro aktivitu DNA polymerázy, aby se hybridizované primery mohly prodloužit.
- Denaturace: Teplota reakce se zvýší na 95 °C, čímž dojde k roztavení (narušení vodíkových vazeb mezi komplementárními bázemi) všech dsDNA na jednořetězcovou DNA (ssDNA).
- Pakování: Kroky 1 až 3 se provádějí cyklicky, což vede k exponenciální amplifikaci amplikonu (obrázek 2.1 a 2.2).
PCR se skládá z cyklů zahřívání a ochlazování reakce. Každé teplotní plato slouží ke kontrole definované fáze reakce a inkubační doby závisí na přístroji, reakčních deskách nebo zkumavkách a činidlech. Ty by měly být optimalizovány pro každý experiment, zejména pokud je požadována zvýšená citlivost detekce5.
Počáteční denaturační fáze se skládá z období při vysoké teplotě, během něhož se sekundární struktura komplexní dvouvláknové DNA (dsDNA) roztaví na jednovláknovou DNA (ssDNA). Vzhledem k tomu, že DNA je vystavena vysoké teplotě, musí být tato fáze dostatečně dlouhá, aby se oddělila všechna vlákna a byla k dispozici pro priming, ale ne tak dlouhá, aby došlo k poškození DNA. Degradace během počátečních (nebo následujících) denaturačních kroků nebo neúplná denaturace má za následek sníženou citlivost detekce5.
Během kratšího denaturačního kroku, který zahajuje cyklování (10 s až 1 min při 95 °C), se vlákna DNA cílové sekvence oddělují a vytvářejí jednotlivá vlákna, stejně jako v počáteční denaturační fázi. Poté se reakce ochladí na teplotu žíhání primerů.
Krok žíhání (30 s až 1 min, při teplotách 45-60 °C) je nutný k tomu, aby se primery navázaly na komplementární sekvenci na každém z jednotlivých vláken DNA. Primery jsou navrženy tak, aby zarovnávaly cíl zájmu a oblast sekvence, která leží mezi nimi, se označuje jako amplikon. Obecně lze odhadnout, že teplota žíhání je o 5 °C nižší než teplota tání duplexu primer-templát DNA.
Závěrečnou fází je krok extenze (20 s až 1 min při 72 °C), který se provádí tak, že DNA polymeráza prodlouží sekvence primerů od 3' každého primeru až po konec amplikonu. Extenze trvající 1 minutu obvykle postačuje k syntéze fragmentů PCR do 2 kilobází (kb). Pro amplifikaci větších fragmentů se prodlužovací krok prodlužuje rychlostí 1 min na kb. Během první extenze nebude délka templátu omezena, a tak budou syntetizovány templáty, které přesahují délku amplikonu. V následujících krocích prodlužování bude délka amplikonu definována sekvencí primerů na obou koncích.
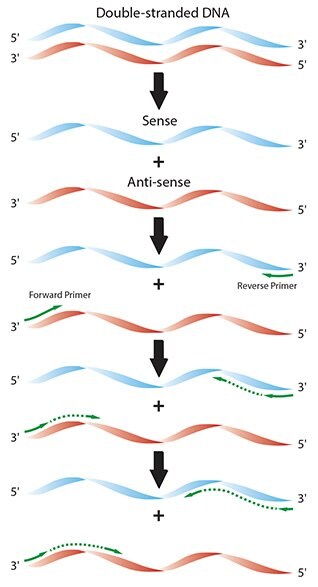
Obrázek 2.1.Schéma jednotlivých reakčních procesů při typické PCR.

Obrázek 2.2.V teoretické PCR se množství cílového amplikonu zdvojnásobuje s každým cyklem, což vede k exponenciální amplifikaci cílové sekvence (osa X znázorňuje cykly PCR a osa Y celkový počet molekul amplikonu).
Na začátku druhého cyklu jsou v reakci dvě formy templátu; původní vlákna DNA a nově syntetizovaná vlákna DNA, která se skládají ze sekvence primeru následované různě dlouhým amplikonem prodlouženým na 3' konci. Zbylá původní vlákna DNA, která nebyla v prvním cyklu primerována, mohou být zachycena ve druhém cyklu a výsledkem jsou molekuly sestávající z primeru a prodlužovacího produktu. Molekuly z prvního cyklu, které byly primedovány a prodlouženy, budou templátem pro primery, které jsou komplementární k nově syntetizovanému materiálu.
Ve třetím cyklu se nově syntetizovaná DNA cílové oblasti, která je výsledkem druhého cyklu, skládá pouze z amplikonu, a proto se stává specifickým templátem.
Cyklus se neustále opakuje, což vede k exponenciální amplifikaci kopírovaných sekvencí (obrázek 2.2). Počet potřebných cyklů závisí na požadované výtěžnosti produktu PCR. Ten zase závisí na počátečním počátečním počtu kopií a účinnosti amplifikace. Vzhledem k tomu, že relativní koncentrace výchozího materiálu vůči konečnému produktu je neuvěřitelně nízká (např, 1/5,511 pokud je jediná molekula podrobena 40 cyklům amplifikace a v každém cyklu je dosaženo 100% účinnosti, obrázek 2.1), výsledná DNA na konci reakce je téměř výhradně amplikon PCR.
Ačkoli by teoreticky měla PCR vést k nepřetržité exponenciální amplifikaci, reakce nakonec dosáhne fáze plateau. To je zřejmě způsobeno nespecifickou vazbou DNA polymerázy na produkty DNA6,7. To je jasně patrné při použití kvantitativní PCR v reálném čase (qPCR) a sledování změn fluorescenčních značek (viz Kvantitativní PCR).
Na konci reakce se amplifikační produkty analyzují pomocí gelové elektroforézy. V závislosti na produkovaném množství a velikosti amplifikovaného fragmentu lze produkty reakce vizualizovat přímo obarvením gelu ethidium bromidem (Obrázek 2.3) nebo pomocí nedávno zavedených barviv, jako je BlueView™ 8.

Obrázek 2.3.Příklad konvenčních produktů PCR rozlišených na agarózovém gelu obarveném ethidium bromidem. Duplexní PCR byla provedena za účelem detekce 2 cílů současně, přičemž každý z nich se liší svou velikostí. Oba fragmenty jsou vidět jako odlišné pásy (obrázek s laskavým svolením Marion Grieβl).
Součásti testu PCR
Níže je uveden přehled součástí, které jsou potřebné pro PCR. Mnohé z nich jsou podrobněji popsány ve zvláštních kapitolách a také v podrobných standardních protokolech PCR na konci této příručky (Příloha A).
Šablona
Existuje několik dostupných metod pro purifikaci RNA a DNA. Ačkoli jsou všechny vhodné, nemusí být všechny stejné. Kontaminace templátu jinými materiály ze zdroje vzorku může vést k inhibici PCR a v extrémních případech k úplnému selhání testu. Existují příklady, které ukazují, že kontaminující látky mohou dokonce vést k zesílení reakce9,10. Viz Purifikace vzorků a hodnocení kvality pro více informací o purifikaci a kontrole kvality šablon a Reverzní transkripce pro informace týkající se reakcí reverzní transkripce (RT). Obvykle se 10 ng až 1 μg genomové DNA (gDNA) přidává do 20-100 μl testů PCR, zatímco reakce syntézy cDNA se ředí 1/5 až 1/10 a do 20-50 μl reakcí se přidává 5 μl.
Primery
Oligonukleotidové primery mají obvykle délku 15-25 nukleotidů se 40-60 % GC a Tm které je podobné pro každý
člen páru. Jednoduchou metodou pro posouzení Tm krátkých olig (<25 bází) je použití vzorce11:
Tm = 4(G + C) + 2(A + T)
Viz PCR/qPCR/dPCR Assay Design pro více informací o návrhu primerů a zacházení s nimi. Odhaduje se, že ideální počáteční teplota pro žíhání je o 5 °C nižší než teplota tání. Teplotu žíhání lze optimalizovat pomocí bloku PCR s teplotním gradientem. Protokol pro optimalizaci teploty (na příkladu qPCR) je uveden v Příloze A.
Polymeráza DNA
Existuje velké množství enzymů polymerázy DNA a je velmi důležité, aby byl správný enzym vybrán na základě definice experimentu (nikoliv pouze na základě dostupnosti daného enzymu v laboratorním mrazáku). Některé enzymy jsou například navrženy tak, aby byly při nízkých teplotách neaktivní, a používají se v protokolech s horkým startem, aby se snížila nespecifická amplifikace, zatímco jiné mají nízkou chybovost a vybírají se pro amplifikaci fragmentů pro klonování.
dNTPs
Koncentrace každého dNTP (dATP, dCTP, dGTP, dTTP) v PCR je obvykle 200 μM. Koncentrace dNTP však musí být v nadbytku a může být nutné ji zvýšit pro amplifikaci dlouhých fragmentů nebo vysoce početných cílů. V poslední době došlo k vylepšení složek pufru PCR, například CleanAmp™ dNTPs12. Jedná se o modifikované nukleosidtrifosfáty, které blokují inkorporaci nukleotidů do DNA polymerázy. CleanAmp dNTPs jsou aktivovány počátečním zahřívacím krokem a následnými denaturačními kroky v typických podmínkách cyklování s horkým startem. Tento proces omezuje množství dostupných aktivovaných dNTP během každého cyklu PCR, což umožňuje specifičtější a účinnější amplifikaci požadovaného produktu. Na druhé straně snižují nebo zcela zamezují chybnému primingu nebo tvorbě dimerů primerů, a proto jsou alternativou k DNA polymerázám s horkým startem.
Koncentrace MgCl2
Volný Mg2+ ionty jsou pro aktivitu DNA polymerázy potřebné jako kofaktor, avšak Mg2+ ionty tvoří komplexy s dNTP, primery a templáty DNA. Z tohoto důvodu je třeba pro každý experiment zvolit optimální koncentraci MgCl2 testováním reakcí obsahujících různé koncentrace. Koncentrace MgCl2 se obvykle pohybuje v rozmezí 1,5 až 5.5 mM, ale během optimalizace může být testována v rozmezí 1-8 mM (viz AAssay Optimization and Validation).
Fluorescenční značky
Fluorescenční barviva se do reakce začleňují v případě, že má být amplikon detekován přímo, například při použití sestavy qPCR nebo digitální PCR (dPCR). Jsou součástí pufru nebo jsou připojena k primerům či dalším sondám (viz Quantitative PCR and Digital PCR Detection Methods).
Přístroje
Původně bylo provádění PCR pracné, protože se provádělo fyzickým přemísťováním reakčních zkumavek mezi 3 vodními lázněmi, z nichž každá byla nastavena na požadovanou teplotu pro denaturaci, žíhání a elongaci. Na horní část reakce se přidával olej, aby se zabránilo odpařování, a bylo složité provést analýzu, aniž by došlo k rušení olejem. Dnes se běžně používá jeden z mnoha specializovaných přístrojů pro termální cyklování, které jsou komerčně dostupné. Formáty destiček a bloků se pohybují mezi 48, 96 nebo 384 jamkami a jsou kompatibilní s vícekanálovými pipetami. Většina z nich používá vyhřívané víko, které eliminuje potřebu překrývání olejem. Existují však i vysoce výkonné přístroje založené na původním principu vodní lázně13.
Modifikace PCR specifické pro danou aplikaci
Různé derivace PCR vyžadují modifikace reakcí. Některé z těchto modifikací pro oblíbené aplikace jsou zde uvedeny.
Klonování
PCR lze použít k amplifikaci vybraných sekvencí pro vložení do vektoru. Tyto sekvence lze upravit tak, aby obsahovaly specifické oblasti (ocásky) pro rozpoznání klonovacího enzymu. K izolaci fragmentů, které již byly naklonovány do vektorů, se používají primery nasměrované na vektor. Pro kroky PCR je nutný enzym DNA polymeráza s nízkou chybovostí.
Místa pro sekvenční značku
Ty jsou navrženy na 5' konci primerů a používají se při vysokokapacitním sekvenování, kdy je specifická značka vyžadována jako indikátor, že ve vybraném klonu je přítomen určitý segment genomu konkrétního vzorku, aby bylo možné dekonvolutovat data genomové sekvence a přiřadit je původnímu zdrojovému vzorku.
Mutageneze řízená místem
Pro studium funkce proteinu lze do sekvence DNA zavést požadovanou mutaci. Požadovaná změna báze se vnese do primerů (směrem k 5' konci), které rovněž obsahují požadovaná restrikční místa klonovacího enzymu. Alternativní přístup využívá vícestupňový protokol, při němž se primery, které jsou specifické pro cíl a obsahují klonovací místa, používají ve spojení s primery obsahujícími požadovanou mutaci.
Materiály
Odkazy
Abyste mohli pokračovat ve čtení, přihlaste se nebo vytvořte účet.
Nemáte účet?