Bioterhelés-ellenőrzés a biológiai feldolgozásban
A biológiai terheltség ellenőrzése kulcsfontosságú a sikeres gyógyszergyártás szempontjából, és egy szennyeződési esemény a folyamat elején vagy végén jelentős fennakadásokat és költségeket okozhat. A kontamináció-ellenőrzés holisztikus átgondolása, a folyamat kritikus pontjainak azonosítása és a kontaminációs kockázat minimalizálását célzó enyhítő intézkedések a kontamináció-ellenőrzési stratégia és a sikeres feldolgozás alapja.
Hogyan különbözik a bioburden ellenőrzése az upstream és downstream feldolgozásban
Upstream folyamatok
A upstream feldolgozásban a bioburden ellenőrzése a nyersanyagok beszerzésére és jellemzésére összpontosít, hogy megakadályozza a véletlenszerű kórokozók sejttenyésztési műveletekbe való bejutását. Ezek a folyamatok jellemzően aszeptikusak, és a sejttenyésztési közegeket általában olyan szűrőkön keresztül dolgozzák fel, amelyek eltávolítják a baktériumokat és a mikoplazmákat, mielőtt a közeget a folyamatba vezetnék. A gyors vizsgálati módszerek segítenek biztosítani, hogy a fertőzött, betakarítás előtti anyag ne kerüljön át a következő folyamatokba.1
Downstream-folyamatok
A legtöbb a monoklonális antitestterápiák downstream műveletei nem minősülnek aszeptikusnak, és "alacsony bioburden" vagy "bioburden-ellenőrzött" üzemmódban működnek. A gyártók általában saját maguk határozzák meg a bioburden szintjét. A BioPhorum Bioburden munkacsoportja arról számolt be, hogy a beavatkozási szinteket általában 1-10 kolóniaképző egység/ml-ben határozzák meg.2 A későbbi feldolgozási folyamat során szigorú aszeptikus ellenőrzésre van szükség, amikor a gyógyszertermék formázása, steril szűrése és injekciós üvegekbe való átvitele történik.
A hatékony bioburden-ellenőrzés három megközelítése:
A hatékony biológiai terheltség-ellenőrzési stratégiák három egymást kiegészítő megközelítésen alapulnak:
- A biológiai terheltség értékelése
- A kockázat mérséklése
- Folyamatos monitorozás a folyamat ellenőrzésének biztosítása érdekében
A bioburden kockázatainak felmérése
A folyamat mikrobiális profiljának felmérése az első lépés a kockázat értékeléséhez; annak megértése, hogy mely mikrobiális szennyezőanyagok vannak jelen és mennyi (pl: nyersanyag-vizsgálat) egy olyan alapszintet biztosít, amelyhez képest a jövőbeli műveletek összehasonlíthatók. Kockázatértékelési eszközökkel kritikusan értékelhető az upstream és downstream folyamatok minden aspektusa a szennyező anyagok potenciális hatásának meghatározása érdekében.3 Ez a módszertani megközelítés a Nemzetközi Harmonizációs Tanács ICH Q9 dokumentumának ajánlásain alapul.4 Az átfogó minőségi kockázatkezelési (QRM) stratégia tudományos megközelítésre támaszkodik mind a kockázatok megértéséhez, mind a kockázatcsökkentő intézkedések rangsorolásához.
A szennyeződés kockázata a tápanyagokban gazdag, a mikrobák elszaporodásához ideális környezet miatt magas az upstream folyamatokban. A kockázatok a végtermékhez közelebbi feldolgozási lépéseknél is magasak, mivel ott kevesebb tisztítási lépés szükséges a mikroorganizmusok eltávolítására, és nagyobb potenciális hatást gyakorolhatnak a termék minőségére és a betegbiztonságra. A köztes feldolgozási lépéseknél azonban a szennyeződés kockázata alacsonyabb, mivel a pufferek és a fertőtlenítőszerek kevésbé kedveznek a mikrobák szaporodásának. Ezt az eltérő kockázatérzékenységet a biogyártási műveletek során "kockázati függőágynak" nevezik, és hasznos lehet a kockázatcsökkentésről való gondolkodás során (1. ábra).
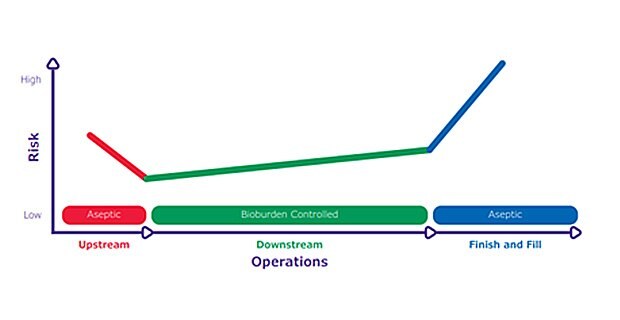
1. ábra.A "kockázati függőágy" rávilágít a biogyártás eltérő kockázatérzékenységére. Az upstream műveletek aszeptikusak és magas a fertőzés kockázata. A downstream műveletek ellenőrzik a biológiai terhelést, és a szennyeződés kockázata alacsonyabb. A befejező és feltöltési lépést aszeptikusan végzik, és bármilyen szennyeződés a legnagyobb kockázatot jelenti a betegbiztonságra nézve.
A mikrobiális szennyeződések számos lehetséges bejutási útvonala van a továbbfeldolgozási folyamatba: helytelen tisztítás vagy fertőtlenítés, kockázatos aszeptikus csatlakozások, a rendszer nem optimális kialakítása és az aszeptikus technika hibái.
A szennyeződés kockázata a köztes feldolgozási lépéseknél ugyan kisebb, de nem nulla. Egyes közbenső feldolgozási lépések olyan komponenseket tartalmaznak, amelyeket többször újra felhasználnak, mint például a kromatográfiás gyanták és az érintőleges áramlású szűrőberendezések. Ezeket az alkatrészeket általában nem lehet sterilizálni, és a biológiai terheltség minimalizálása érdekében fertőtlenítést végeznek. Sajnos a csomagolt kromatográfiás oszlopok ideális környezetet biztosítanak a mikrobák szaporodásához és a biofilmek kialakulásához. A Protein A oszlop különösen problematikus, mivel ez az első tisztítási lépés, amely tápanyagban gazdag anyaggal van megtöltve, ami elősegíti a mikrobák növekedését. Ez, valamint az a tény, hogy számos hatékony fertőtlenítő megoldás negatívan befolyásolhatja a gyanták teljesítményét, különösen nagy kihívást jelent a Protein A befogási lépés mikrobiológiai ellenőrzése szempontjából.
A bioburden kockázatainak csökkentése a biofeldolgozásban
A bioburden kockázatának csökkentése az anyagok ellenőrzésén, a létesítmény tisztításán és fertőtlenítésén, az elszigetelésen és a szennyeződések szűréssel történő eltávolításán alapul. A mikrobák biofarmáciai gyártási folyamatokba való bejutásának megakadályozása a nyersanyagok gyártásához és a származási hely, a szállító és a beszállító minőségirányítási rendszereinek gondos mérlegelése. Ezen túlmenően a szállító által az anyagra adott jellemzés és a javasolt minőségi szint (lásd M-Clarity™ Program) hatással lehet a felhasználás előtti kezelésre és feldolgozásra, vagy akár a szállítóváltást is eredményezheti.
A fertőtlenítőszerek különösen fontosak a köztes feldolgozási lépésekben, ahol az aszeptikus műveletekre nincs lehetőség. A fertőtlenítés csökkenti, de nem szünteti meg a biológiai terhelést, és növelheti a mikrobiális sejttörmelék, például a baktériumok által termelt hidrofób lipopoliszacharid molekulák (endotoxinok), a kezelést követően. Emiatt gyakran előnyös a biológiai terhelést elszigeteléssel és szűréssel minimalizálni, ahelyett, hogy kizárólag a fertőtlenítésre támaszkodnánk a mikrobák elpusztítása érdekében.
Az olyan elszigetelések, mint a single-use-assemblies és sterilizált folyadékátviteli rendszerek összekötik az egyszer használatos folyadékpályákat a technológiai lépések között, minimalizálják a mikrobák bejutását, és mivel előre sterilizáltan állnak rendelkezésre, nem járulhatnak hozzá a bioburden szinthez. Hasonlóképpen, zárt mintavételi technológiák minimalizálják a szennyeződések termékáramlási útvonalba való bejutásának kockázatát. A szűrés kiváló lehetőség a biológiai terheltség ellenőrzésére, de a bevezetés előtt meg kell határozni és optimalizálni kell a folyamattervezést és a legjobb üzemeltetési gyakorlatokat. Bármely egyszer használatos rendszernek vagy szűrőnek kompatibilisnek kell lennie a folyamatfolyadékkal, és meg kell felelnie a biológiai szennyeződések ellenőrzésére, a feldolgozás hatékonyságára és a költségekre vonatkozó teljesítményigényeknek.
Szűrési megfontolások a bioburden ellenőrzéséhez
Upstream műveletek: Membránszűrők 0.1 µm vagy 0,2 µm membránpórusmérettel rendelkező membránszűrőket jellemzően sejttenyésztési közegek feldolgozására használják. A szűrők kiválasztása a feldolgozási költségeken, a gyártó tapasztalatain és a kockázattűrés szintjén alapul.
Közepes downstream műveletek: Sterilizáló minőségű vagy bioburden-csökkentő szűrők használhatók. A gyártó bioburden-profilja és a kockázatértékelés eredményei alapján a folyamat sajátos igényeinek megértése kell, hogy irányadó legyen a szűrők kiválasztásánál.
A végső steril szűrés: Egy folyékony technológiai áramlatokhoz való sterilizálási minőségű szűrő olyan membránt tartalmaz, amelynek névleges pórusmérete 0.2 µm vagy annál kisebb, az ASTM F838 baktérium-visszatartási szabvány alapján validált. Ezenkívül a biogyártóknak szűrő validálási vizsgálatokat kell végezniük, hogy megerősítsék a szűrő sterilizálási minőségű teljesítményét és a folyadékáramukkal való kompatibilitását a folyamat körülményei között.
A kontroll fenntartása a biológiai terheltség monitorozásával
A monitorozás segít meghatározni a jellemző biológiai terheltségi szinteket a downstream műveletekben, és a küszöbérték túllépése esetén vizsgálatot indíthat. A szennyezőanyag típusának megértése segíthet a probléma forrásának azonosításában és a korrekciós intézkedések meghatározásában.
A bioburden biztonságának a mintavételezéssel és a vizsgálatokkal való kiegyensúlyozása mindig kihívást jelent, és az egyes folyamatokhoz megfelelő stratégia meghatározásához kockázatelemzésre támaszkodik. A bioburden kitérések valós kockázatot jelentenek a gyártási folyamatra - zavaróak és költségesek lehetnek. A hatékony ellenőrzés a folyamat megértésén és egy átfogó csökkentési terven alapul a biztonságos gyógyszergyártás biztosítása érdekében.
Download the Bioburden and Aseptic Control eBook
Our eBook "Mission Control: Strategies for Effective Bioburden and Aseptic Control" című kiadványunk a biológiai terheltség ellenőrzésének különböző aspektusaival foglalkozik.
A témák közé tartoznak:
- A bioburden ellenőrzés részletesebb áttekintése a downstream feldolgozásban
- Hogyan válasszon szűrőket a bioburden kihívás alapján
- A sterilizáló minőségű szűrés hatékonyságának maximalizálására vonatkozó megfontolások /li>
- A steril szűrés iparági trendjei
- Hogyan minimalizálják a kockázatot a tervezésen alapuló minőségi megközelítések
Töltse ki az alábbi űrlapot, hogy az e-könyvet egyenesen az Ön postaládájába küldjük.
Hivatkozások
Az olvasás folytatásához jelentkezzen be vagy hozzon létre egy felhasználói fiókot.
Még nem rendelkezik fiókkal?