Kyselina sialová
Kyselina sialová je důležitou součástí glykanových struktur. Odhalte funkce kyseliny sialové, její syntézu, modifikace, signalizaci a další. Najděte také produkty pro výzkum kyseliny sialové pohodlně rozdělené podle kategorií.
Přečtěte si více o
Co je to kyselina sialová?
Kyseliny sialové se řadí mezi sacharidy, ale strukturálně se liší od ostatních běžných cukrů. Přestože neobsahují striktní polyolovou strukturu ([-CHOH-]n) typickou pro základní sacharidy, jsou kyseliny sialové substituenty glykanových struktur a nejčastěji se objevují jako neredukující koncové molekuly N-glykany, O-glykany a proteiny ukotvené v glykosylfosfatidylinositolu (GPI). Sialové kyseliny se od ostatních cukrů liší také tím, že jsou méně často využívány jako zdroj energie, ale mají zásadní význam pro vývoj, buněčné rozpoznávání, vazbu mezi buňkami a signalizaci. Všechny eukaryotické systémy a některá prokaryota exprimují sialové kyseliny a další patogenní bakterie, viry a parazité využívají sialové kyseliny na povrchu buněk jako ligandy k přilnutí k buňkám, přičemž nejznámějším příkladem patogenů vázajících sialové kyseliny jsou chřipkové viry.
Syntéza a signalizace kyseliny sialové
Všechny kyseliny sialové jsou založeny na cyklické devítiuhlíkaté struktuře se skupinou kyseliny karboxylové v poloze C1 (viz obrázek 1). Kvůli skupině kyseliny karboxylové mají kyseliny sialové přirozený záporný náboj. Nejběžnější sialové kyseliny jsou N-acetylneuraminová kyselina (Neu5Ac, NeuNAc nebo NANA), N.-glykolylneuraminová kyselina (Neu5Glc) a N-acetyl-9-O-acetylneuraminová kyselina (Neu5,9Ac2).1 Substituce mohou být provedeny na uhlících C4, C7, C8 a C9 a na aminu nacházejícím se na C5 a k rozmanitosti možných struktur přispívá více substitucí. Hydroxylové skupiny nacházející se na C4, C7, C8 a C9 mohou podléhat acetylaci, fosforylaci, sulfataci nebo methylaci. Dosud bylo identifikováno více než 50 forem kyseliny sialové, což je dáno množstvím míst, která jsou k dispozici pro strukturní modifikaci, a také variabilitou jádra. Dalším faktorem, který přispívá ke složitosti kyseliny sialové in vivo , je migrace O-acetylesterové části mezi C7 a C9 za určitých fyziologických podmínek.
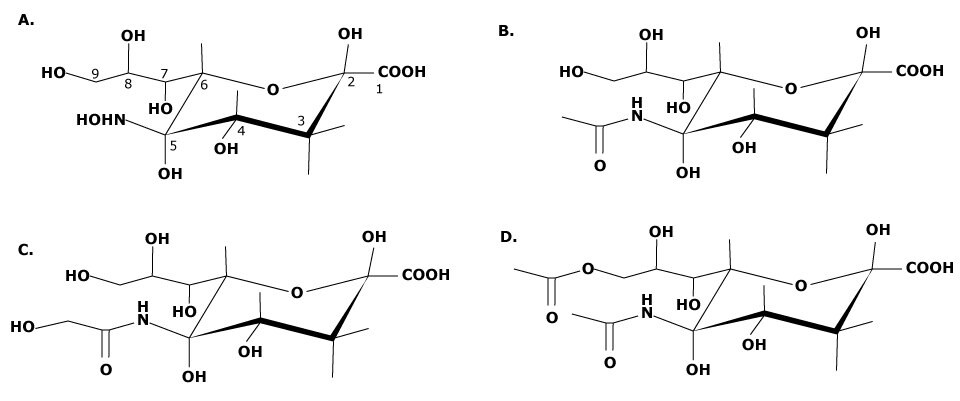
Obrázek 1.(a) Kyselina neuraminová, základní struktura všech sialových kyselin. Strukturní modifikace mohou být provedeny na C4, C7, C8, C9 a na aminoskupině C5. (b) Struktura N-acetylneuraminové kyseliny (Neu5Ac). (c) Struktura N-glykolylneuraminové kyseliny (Neu5Gc). (d) Struktura N-acetyl-9-O-acetylneuraminové kyseliny (Neu5,9Ac2).
Životní cyklus sialových kyselin u obratlovců probíhá podle jasného schématu od syntézy přes transport, navázání a odstranění. Po odstranění mohou být kyseliny sialové recyklovány navázáním na cytidin 5'-trifosfát (CTP) pro opětovné použití jako substrát, nebo může být kyselina sialová degradována působením pyruvátlyázy a esteráz specifických pro kyselinu sialovou (viz obrázek 2). Altheide, et al., rozdělili procesy, kterých se účastní kyseliny sialové, do pěti kroků2:
- Biosyntéza - stavba kyselin sialových z prekurzorů
- Aktivace, transport a přenos - tvorba donorských substrátů kyselin sialových a jejich připojení ke glykanům působením transferáz
- Modifikace - přidávání a přemisťování modifikací kyseliny sialové
- Recognition (rozpoznávání) - vazba nebo vazba proteinů rozpoznávajících kyselinu sialovou na sialoglykany
- Recyklace a degradace - proces enzymatického odstraňování zbytků kyseliny sialové a degradace volné kyseliny sialové.
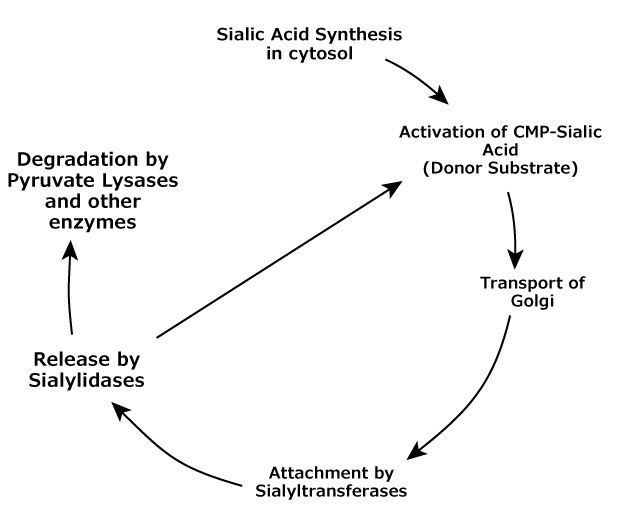
Obrázek 2.Životní cyklus metabolismu kyseliny sialové u obratlovců.
Biosyntéza kyselin sialových
Syntéza kyselin sialových u živočichů probíhá především v cytosolu a zahrnuje čtyři enzymy účastnící se pětistupňového procesu (viz obrázek 3). Enzym s dvojí aktivitou UDP-GlcNAc 2-epimeráza/mannac-6-kináza (genový symbol GNE) přeměňuje výchozí substrát uridin 5'-difosfát-.N-acetyl-D-glukosamin (UDPGlcNAc) na N-acetyl-D-mannosamin (ManNAc) s odstraněním části UDP a epimerizací sacharidu. Kinázová funkce téhož enzymu fosforyluje cukr za vzniku N-acetyl-D-manosa-6-fosfátu (ManNAc-6-P). Výsledkem kondenzační reakce mezi fosfoenolpyruvátem (PEP) a ManNAc-6-P iniciované NeuAc-9-P-syntetázou (genový symbol NANS) je fosforylovaný prekurzor kyseliny sialové N-acetylneuraminová kyselina 9-fosfát (Neu5Ac-9-P). Tento prekurzor je defosforylován Neu5Ac-9-P-fosfatázou (genový symbol NANP) za vzniku klíčové kyseliny sialové N-acetylneuraminové (2-ketoacetamido-3,5-dideoxy-D-glycero-D-galaktonulosonová kyselina; Neu5Ac).
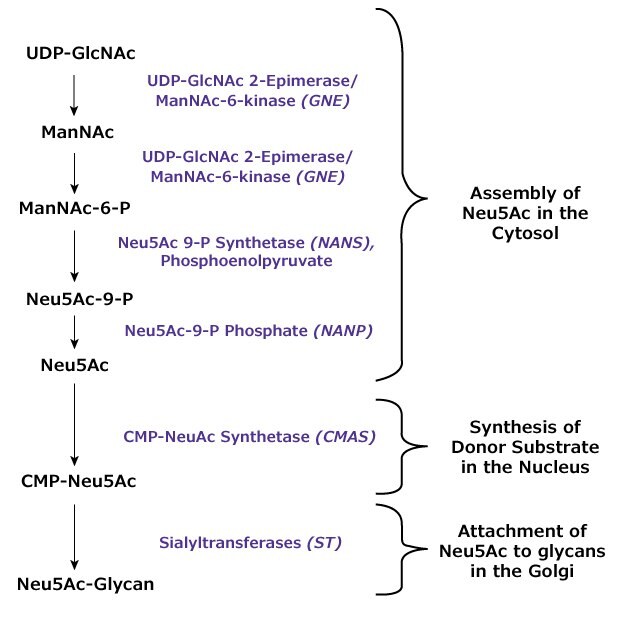
Obrázek 3.Schéma enzymatické syntézy kyseliny N-acetylneuraminové (Neu5Ac) a jejího navázání na glykanové struktury.
Přenos kyselin sialových
Po biosyntéze musí být Neu5Ac začleněn jako donorový substrát nukleotidů pro následný přenos do oligosacharidové struktury. Toto vytváření substrátu probíhá v jádře eukaryotických buněk. Neu5Ac je transportován do jádra, kde je připojen k cytidin 5'-trifosfátu (CTP) za vzniku donorového substrátu CMP-Neu5Ac se ztrátou pyrofosfátu prostřednictvím katalýzy enzymem CMP-NeuAc syntetázou (kód genuCMAS). Substrát CMP-Neu5Ac je poté transportován zpět do cytoplazmy a následně do Golgiho, kde je využit sialyltransferázami.
Sialyltransferázy (ST) Golgiho připojují zbytky Neu5Ac k oligosacharidům za použití CMP-Neu5Ac jako donorského cukru. Tyto transferázy vytvářejí specifické glykosidické vazby pro kyselinu sialovou (α2→3, α2→6 nebo α2→8) a mají preference pro monosacharidové akceptory používané při připojování. Tyto specifity jsou označeny enzymovou nomenklaturou, např. ST6Gal I je sialyltransferáza, která vytváří vazby α2→6 na galaktózu.
Inhibitory enzymů jsou běžně navrhovány na základě strukturní podobnosti s funkčními receptory nebo substráty, přičemž se očekává, že inhibitor bude enzymem neúplně zpracován a reakce bude abnormálně ukončena. Tento koncept byl použit při pokusech s analogy ManNAc obsahujícími nepřirozené struktury jako způsob, jak zabránit syntéze kyseliny sialové. Namísto zásahu do syntézy kyseliny sialové však byly analogy zpracovány enzymatickou syntézou s neporušenou nepřirozenou složkou a následně začleněny na terminus oligosacharidů. Tento nedostatek substrátové selektivity nemusí být zcela překvapivý, protože bylo prokázáno, že cesta syntézy kyseliny sialové je nezbytná pro přežití obratlovců. Bylo zjištěno, že eliminace UDP-GlcNAc-2-epimerázy je letální u knockoutovaného myšího modelu.3Schopnost inkorporace nepřirozených analogů kyseliny sialové do glykanových oligosacharidů umožnila výzkumníkům využít tuto substrátovou flexibilitu jako prostředek pro studium přínosu sialylace pro buněčnou biologii. Metabolická inkorporace byla kombinována s chemoselektivními ligaturačními strategiemi, při nichž je nepřirozená skupina analogu kyseliny sialové k dispozici pro kovalentní vazbu s detekční nebo připojovací molekulou.4Campbell, et al., provedl přehled nepřirozených monosacharidů, které lze začlenit pomocí metabolického značení, přičemž nejúspěšnější pro použití v oligosacharidovém inženýrství jsou analogyN-acetyl-D-mannosaminu a kyseliny sialové.5Metabolické inženýrství kyseliny sialové bylo také použito při studiu virové adheze a regulace vrozeného imunitního systému. Nepřirozené analogy mannosaminu byly použity ke zkoumání požadavků na glykanovou specifitu vazby virového hemaglutininu a imunotargetingu nádorových buněk, které exprimují kyselinu polysalovou.5,6
Modifikace kyselin sialových
Modifikace na kyselinu neuraminovou probíhá v Golgi, a to buď před přenosem sacharidové části na sacharidový akceptor, nebo po přenosu. Výjimkou je vývoj N-glykolylneuraminové kyseliny (Neu5Gc), hydroxylované formy Neu5Ac. U obratlovců jiných než člověk, včetně ostatních primátů, se Neu5Ac přeměňuje na Neu5Gc v cytosolu působením hydroxylázy cytidinmonofosfátu-N-acetylneuraminové kyseliny (CMP-N-acetylneuraminát monooxygenáza; genový symbol CMAH). Evoluce člověka vedla k eliminaci tohoto genu, takže zatímco Neu5Gc je běžnou kyselinou sialovou u jiných obratlovců, u člověka se přirozeně nevyskytuje.2 Enzymy a mechanismy, kterými jsou kyseliny sialové následně modifikovány, nejsou dobře definovány.
Rozpoznávání kyseliny sialové a biologická funkce
Kyseliny sialové a sialylované glykoproteiny a glykokonjugáty jsou nezbytné pro správný vývoj savců. Vzhledem k tomu, že sialové kyseliny se obvykle nacházejí na terminálním konci glykanové struktury, a vzhledem k jejich kyselé, negativně nabité povaze mohou sialylované glykokonjugáty inhibovat mnoho mezimolekulárních a mezibuněčných reakcí. Jak již bylo uvedeno, schopnost syntetizovat sialové kyseliny se ukázala jako nezbytná pro přežití a vývoj myší.3 Kyselina polysialová je posttranslační modifikací glykoproteinu NCAM (neural cell adhesion molecule) a její přítomnost je nezbytná pro postnatální vývoj neuronů, zatímco kyselina sialová je kritickou složkou mozkových gangliosidů (sialylovaných glykosfingolipidů) a sialové kyseliny v potravě jsou nezbytné pro normální vývoj mozku savců.7
Kyseliny sialové jsou kritickou součástí vrozeného imunitního systému obratlovců. Klíčovými proteiny, které rozpoznávají sialové kyseliny, jsou lektinů, které zahrnují hlavní podrodinu sektinů vázajících imunovéglobulinu podobné lektiny (Siglecs). Stručně řečeno, proteiny Siglec jsou exprimovány na povrchu buněk a jsou vysoce specifické pro sialylované ligandy. Koncové sialové kyseliny na glykokonjugátech na povrchu buněk působí jako ligandy pro Siglecs na povrchu buněk, maskují Siglecs a zabraňují vazbě na vnější patogeny. Diskuse o Siglecs a jejich úloze ve vrozeném imunitním systému zde není zahrnuta; pro další informace je čtenář odkázán na definitivní přehledy.8-10 Připojením k blízkým sialylovaným glykanům rovněž na povrchu buněk vytvářejí tyto proteiny "cis" vazby, které snižují pravděpodobnost připojení viru a pomáhají chránit ("maskovat") sialylované glykany před vnějším připojením k virovým hemaglutininům.
Tato cis vazba terminálních sialových kyselin na sigleky byla popsána jako identifikace buňky jako "vlastní" pro imunitní systém a zabránění útoku makrofágů a dalších buněk imunitního systému.8 Ztráta terminálních sialových kyselin štěpením sialidázou odmaskuje Siglecs a zpřístupní Siglecs pro vazbu na jinou hostitelskou buňku ("trans" vazba) nebo na patogen, který má silnější afinitu k vazebnému místu Siglec. Terminální sialové kyseliny také chrání předposlední glykokonjugované cukry, především galaktózu, před receptory vázajícími sacharidy, jako jsou galektiny (lektiny specifické pro galaktózu u obratlovců), které jsou spojeny se zánětem, apoptózou a reakcemi imunitních buněk.
Další skupinou membránových proteinů, které mají afinitu k sialylovaným ligandům, jsou selektiny, rodina lektinů závislých na vápníku, které jsou exprimovány endotelovými buňkami, leukocyty a krevními destičkami. Selektiny mají slabou afinitu k sialylovanému Lewisovu antigenu X (SLeX), který je spojován s rakovinou, a mnoho identifikovaných ligandů s vyšší afinitou k selektinům je sialylovaných i fukosylovaných. Selektiny exprimované na povrchu cévních endoteliálních buněk v oblastech zánětu adherují k sialylovaným ligandům přítomným na leukocytech a krevních destičkách. Tato slabá adheze poutá cirkulující leukocyty a zpomaluje jejich transport venulou. Leukocyty jsou krátce připoutány a valí se po povrchu endotelových buněk, což zpomaluje jejich transport a umožňuje signalizaci chemokinovými receptory, která aktivuje expresi integrinů leukocyty. Leukocyty se nakonec naváží na povrch cévy prostřednictvím vazby mezi integrinem a imunoglobulinovou superrodinou a migrují cévní stěnou k poškozené tkáni.
N-Acetylneuraminová kyselina je schopna vychytávat volné radikály včetně peroxidu vodíku a lipidových hydroperoxidů,11 a další sialové kyseliny mohou mít také antioxidační aktivity. Hovězí submaxilární mucin byl schopen snížit degradaci plazmidové DNA hydroxylovými radikály, ale desialylovaný mucin oxidační degradaci DNA nezabránil.12 Bylo prokázáno, že léčba intravenózní kyselinou sialovou působí proti lipopolysacharidem indukované jaterní toxemii u potkanů.13
Kyselina sialová je součástí α-podjednotky napěťově řízených sodíkových kanálů, u nichž molekula podjednotky obsahuje odhadem 100 zbytků kyseliny sialové. Nedostatečná sialylace podjednotky, ať už při expresi v buněčné linii, která není schopna správně sialylovat proteiny, nebo deglykosylací, vede k větší depolarizaci kanálů. Bylo prokázáno, že sialylace podjednotky β1 nepřímo podporuje bránění sodíkového kanálu podjednotkou α.14 Tato funkce kyseliny sialové při bránění sodíkového kanálu byla zkoumána jako možný cíl pro léčbu epileptických záchvatů. Při ošetření potkaního hipokampu neuraminidázou za účelem snížení počtu povrchových zbytků kyseliny sialové bylo zjištěno, že jak in vitro , tak in vivo modely epilepsie vykazují sníženou náchylnost k záchvatům.15
Změny v expresi sialylace, včetně zvýšení hladiny sialylace a změn modifikací kyseliny sialové, byly identifikovány v nádorových buňkách. Zvýšení sialylace u rakoviny může být způsobeno nadměrnou expresí sialyltransferáz.16 Sialylované Lewis X (SLex)a sialylované Lewis a (SLea) (viz obrázek 4) sacharidové struktury byly identifikovány jako nádorové antigeny s vyšší úrovní exprese v několika typech nádorových buněk.17 SLea působí jako ligand pro endoteliální E-selektin , selektin, který je exprimován po indukci zánětlivými událostmi v závislosti na cytokinech. Sialyl Lewisx/a může hrát roli v adhezi nádorových buněk k endometriu zprostředkované E-selektinem.18 Zvýšení sérových hladin kyseliny sialové bylo zjištěno také u pacientů s diabetem nebo hypertenzí.19
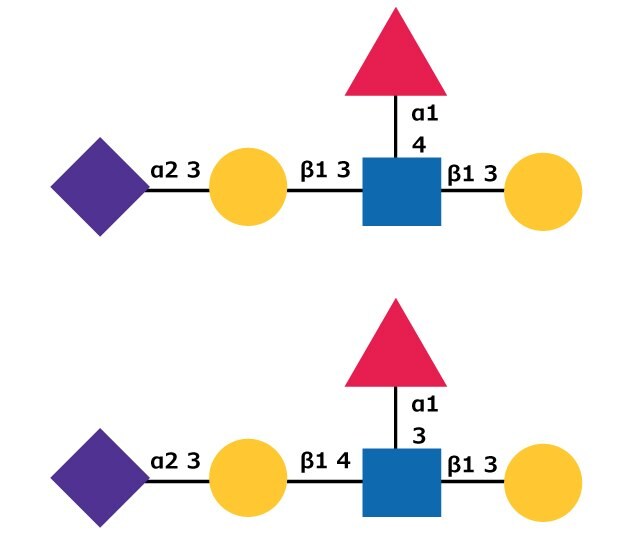
Obrázek 4.Struktura sacharidů pro sialyl Lewisa (nahoře) a sialyl Lewisx (dole) oligosacharidy. Viz obvyklá nomenklatura symbolů pro identifikaci sacharidů.
Kyseliny sialové a patogeny
Několik patogenních organismů včetně viru chřipky využívá sialové kyseliny na povrchu buněk k připojení a infekci.20 Chřipka má dvě komplementární aktivity vůči sialovým kyselinám na povrchu buněk, aktivitu hemaglutininu, který se váže přednostně na sialové kyseliny, a aktivitu neuraminidázy, která je schopna odštěpovat terminální zbytky kyseliny sialové z oligosacharidů. Společná zkratka pro chřipkové kmeny odráží přítomnost hemaglutininu (H) a neuraminidázy (N). Viry využívají terminální sialové kyseliny na povrchu eukaryot jako ligandy pro připojení k buňce za účelem infekce. Tyto "trans" vazby mají obvykle nízký vazebný koeficient, takže za účelem posílení vazeb na hostitelskou buňku je mezi virem a hostitelem obvykle velký počet vazeb. Tato vazba umožňuje viru přenést svou RNA do hostitelské buňky pro následnou infekci a kopírování. Je známo 16 sérotypů chřipkových hemaglutininů a ty mají specifické preference receptorů pro terminální sialové kyseliny. Ptačí virové hemaglutininy se přednostně vážou na sialové kyseliny spojené α(2→3) s galaktózou, zatímco lidské virové hemaglutininy mají větší afinitu k sialovým kyselinám s vazbami α(2→6).21,22 Tato preference vazeb pomáhá snižovat riziko infekce ptačí a lidské chřipky. Takové přenosy jsou však možné. Virus pandemické chřipky z roku 1918 obsahoval mutaci, která se dokázala navázat jak na α(2→3), tak na α(2→6) kyseliny sialové. Kromě preferencí vazby na kyseliny sialové může mít vazba virového hemaglutininu také další strukturní požadavky na oligosacharidy.23
Po infekci neuraminidázová aktivita viru štěpí skupiny kyseliny sialové, které drží virus přichycený k buňce, a uvolňuje nově vzniklé virové částice. Dvě klíčová protivirová léčiva, zanamivir a oseltamivir, jsou inhibitory neuraminidázy (NAI) vyvinuté s využitím racionálního návrhu léčiv a struktury proteinu chřipkové neuraminidázy.24 Mechanismus účinku těchto inhibitorů spočívá v obsazení aktivního místa neuraminidázy a blokování glykolytické aktivity. Aktivita hemaglutininu nově vzniklé částice viru přichytí k povrchu hostitelské buňky a zabrání jejich úniku do extracelulárního prostoru.25
Kromě inhibice neuraminidázy jako prostředku boje proti chřipkové infekci byly prověřovány oligosacharidy na bázi kyseliny sialové, které jsou vhodné jako ligandy pro chřipkový hemaglutinin. Teoreticky by léčiva na bázi sialyloglykokonjugátů mohla být účinná při prevenci vazby viru na buněčné povrchy tím, že se kompetitivně vážou na virový hemaglutinin.22
Zatímco schopnost virů vázat sialové kyseliny je intenzivně studována, jiné patogenní bakterie, včetně Escherichia coli, se již v současné době nacházejí v ./i>, Neisseria meningitidis a Streptococcus agalactiae jsou schopny syntetizovat N-acetylneuraminovou kyselinu. Byla vyslovena hypotéza, že tyto sialové kyseliny na povrchu bakteriálních buněk napodobují sialylované glykany na hostitelské buňce a maskují bakterie před imunitním systémem hostitele.26 Klíčový enzym v syntéze kyseliny sialové, CMP syntetáza kyseliny sialové, byl identifikován jako potenciální cíl pro vývoj farmakoterapie proti bakteriálním patogenům.27
Parazit Plasmodium falciparum, který je původcem maligní malárie u lidí, používá k přichycení na lidské erytrocyty hemaglutininy, které se přednostně vážou na Neu5Ac. Nicméně, P. falciparum má další nadbytečné infekční mechanismy, které jsou nezávislé na kyselině sialové, což přispívá k obtížím při vývoji preventivní léčby malárie.28
Hloubka znalostí týkajících se sialových kyselin a proteinů, které se na ně specificky vážou, se rychle rozšířila; v roce 2002 se předpokládalo, že počet struktur kyseliny sialové je přibližně 40; v následujícím desetiletí bylo identifikováno dalších 10 struktur. Podrobnosti o procesech, kterých se sialové kyseliny účastní, interpretace těchto aktivit a důvody, proč dochází ke změnám exprese sialových kyselin při patologických stavech, jsou však stále nejednoznačné a jsou předmětem pokračujícího výzkumu. Vzhledem k tomu, že změny v buněčné sialylaci jsou spojovány s rakovinou, infekcemi, cukrovkou a dalšími nemocemi, je výzkum kyseliny sialové připraven být zajímavý pro vědce, kteří se snaží pochopit roli sialylace jako možné příčiny, následku nebo indikátoru těchto poruch.
Další technické zdroje najdete na naší Stránce rozbočovače glykobiologie.
Sialové kyseliny a sialové oligosacharidy
Syntéza kyseliny sialové
Transferázy kyseliny sialové
Enzymy degradující kyselinu sialovou
Sialylované polysacharidy
Desialylované polysacharidy
Neuraminidázy (sialidázy)
Substráty pro detekci neuraminidázy
Inhibitory enzymů
Protilátky proti metabolickým enzymům kyseliny sálové
Sialyl-vázající lektiny
Detekce kyseliny sialové
Reference
1-20
21-28
Abyste mohli pokračovat ve čtení, přihlaste se nebo vytvořte účet.
Nemáte účet?