Klíčové kroky v protokolech průtokové cytometrie
Malé detaily v klíčových krocích průtokové cytometrie mohou mít zásadní vliv na výsledná data. Většina protokolů průtokové cytometrie obsahuje čtyři kroky:
Příprava vzorků
Každou populaci buněk, kterou lze vytvořit do jedné buněčné suspenze, lze hodnotit průtokovou cytometrií. Je třeba vzít v úvahu následující tři body:
- Pro přípravu ex vivo buněčné populace se čerstvě vypreparovaná tkáň často jemně homogenizuje pomocí mechanických disociačních metod a různé typy buněk se oddělí pomocí centrifugace s gradientem hustoty, aby se odstranil materiál intracelulární matrix, zbytky a nerelevantní buněčné populace.
- Je důležité si uvědomit, že adherentní buňky musí být před použitím odděleny od povrchu nádoby s buněčnou kulturou pomocí enzymatických roztoků nebo činidel pro chelataci vápníku.
- Suspendované buněčné kultury je třeba pouze spočítat a posoudit jejich životaschopnost.
Počty buněk/tisíce se vztahují k životaschopným buňkám v suspenzi, které lze stanovit pomocí automatického počítadla buněk a použitím gatingu k vyloučení mrtvých buněk/odpadků. Alternativně lze životaschopnost hodnotit pomocí mikroskopického počítání počtu živých buněk ve známém objemu, například pomocí hemocytometru a barviva Trypanova modř, které je vyloučeno neporušenou membránou živých buněk a pouze neživé mrtvé buňky toto barvivo pohlcují.
Blokování
Aby se zabránilo nespecifické vazbě primární protilátky (primárních protilátek) na suspendované buňky, lze použít ředění protilátky anti-Fc (specifické pro daný druh vzorku). Tím se zabrání vazbě Fc nebo konstantní oblasti protilátky Fc receptory, které jsou přítomny na většině typů buněk. Blok Fc se obvykle přidává k promytým buňkám v malém objemu. Ředění barvící protilátky se přidává ihned na konci blokovací inkubace bez proplachovacího kroku. Tím je zajištěno, že blokování nespecifické vazby protilátek zůstane zachováno po celou dobu.
Inkubace protilátky
Inkubace primární protilátky
Podrobná inkubace protilátkyNa rozdíl od jiných aplikací založených na protilátkách, jako je imunohistochemie, není ředění protilátek pro průtokovou cytometrii obvykle založeno na hmotnosti protilátky na objem pufru, ale na hmotnosti protilátky na počet buněk ve vzorku. Stejně jako u jiných aplikací musí být optimální koncentrace stanovena empiricky. Protilátku lze ředit v pufru pro průtokovou cytometrii. Barvení v malých objemech zlepšuje přístup protilátky k buňkám v suspenzi. Na konci inkubace by se buňky měly alespoň třikrát propláchnout v barvicím nebo testovacím pufru, aby se odstranila nenavázaná primární protilátka.
Inkubace sekundární protilátky
Pokud se používá technika nepřímé detekce, po primární inkubaci následuje inkubace s vhodným ředěním sekundární protilátky specifické pro izotyp každé použité primární protilátky. Při vícebarevných detekčních experimentech musí být pro každou sekundární protilátku vybrány fluorofory dostatečně odlišných vlnových délek nebo barev, aby bylo možné rozlišit signál z každého cíle. Inkubace se sekundární protilátkou musí probíhat ve tmě, aby byly chráněny fluorofory citlivé na světlo, a stejně jako dříve by měly být vzorky uchovávány na ledu a odstřeďovány při 4 °C.
Fluorochromy
Mnoho protilátek používaných v průtokové cytometrii je přímo konjugováno s fluorochromem; mnoho neznačených primárních protilátek se však běžně používá v kombinaci se značenými sekundárními protilátkami. Dva nejčastěji používané fluorochromy v průtokové cytometrii jsou fluorescein isothiokyanát (FITC) a fykoerythrin (PE). Dvě klíčové vlastnosti těchto barviv, které z nich činí preferované značky, jsou, že obě jsou excitovány laserem o vlnové délce 488 nm a že jejich emisní spektra jsou odlišná, přičemž FITC má vlnovou délku 530 nm (zelená) a PE 570 - 575 nm (oranžová). Pokroky v chemii fluorochromů a v přístrojovém vybavení průtokové cytometrie umožnily vícenásobné současné značení a třídění buněk nad rámec původních dvou barviv.

Obrázek 1.FluoroFinder® Výstup prohlížeče spekter s excitačními a emisními vlnovými délkami různých fluoroforů. Zleva doprava mFluor 450, Alexa Fluor 488, PE, APC, iFluor 700 a iFluor 750.
Maximální počet proměnných, které lze v daném experimentu průtokové cytometrie zkoumat, závisí na počtu dostupných zdrojů světla a detektorů. Průtokový cytometr s více lasery dává výzkumníkům možnost používat současně fluorofory, které nesdílejí stejné excitační spektrum, což rozšiřuje počet protilátek, které lze použít. Navíc kombinace více laserů s více kanály může dokonce rozlišit dva fluorofory s odlišným excitačním, ale podobným emisním spektrem, protože zařízení s paralelním uspořádáním laserů mohou shromažďovat odlišné emisní signály z jedné částice, protože je excitována postupně každým laserem.
Tipy pro výběr vhodných fluorochromů:
- Vyberte nejjasnější sadu fluorochromů pro konfiguraci vašeho přístroje.
- V závislosti na konfiguraci přístroje zvolte fluorochromy tak, abyste minimalizovali spektrální překrývání.
- Vyhrazujte nejjasnější fluorochromy pro slabší protilátky a naopak.
- Vyhněte se přelévání jasných buněčných populací do detektorů vyžadujících vysokou citlivost pro tyto populace.
- Vyhněte se degradaci tandemových barviv a zvažte její dopad na výsledky.
Chcete-li se dozvědět více o výběru vhodných fluorochromů, podívejte se na naše průvodce výběrem správného fluorochromu/a> pro váš experiment průtokové cytometrie a sestavení optimálního panelu pro analýzu vícebarevnou průtokovou cytometrií.
Fixace a skladování
Po dokončení barvení povrchových antigenů lze buňky místo resuspendování pro získání fixovat v paraformaldehydu ve fosfátovém pufrovaném roztoku. Tento postup je užitečný v případě, že vzorky nelze pořídit ihned po obarvení, protože umožňuje skladování buněk přes noc při 4 °C. Poté je třeba fixační činidlo naředit a buňky alespoň dvakrát propláchnout. Ačkoli se doporučuje akvizice ihned po barvení, fixované buňky, které byly skladovány při 4 °C a chráněny před světlem, lze získat až 48 hodin po fixaci.
Intracelulární cíle:
Pokud je protein(y), který(é) je(jsou) předmětem zájmu, intracelulární, je fixace buněk po barvení povrchu nezbytná pro zvýšení strukturální pevnosti, aby buňky vydržely následnou permeabilizaci potřebnou k umožnění přístupu protilátek k intracelulárnímu antigenu. Buňky, které byly fixovány a promyty, lze permeabilizovat inkubací s vhodným detergentem ve fosfátovém pufrovaném roztoku po dobu nejvýše 15 minut při pokojové teplotě, poté se roztok detergentu zředí a jednou promyje. Doporučují se neiontové detergenty, jako je saponin. Během všech kroků zahrnujících protilátky nebo streptavidin musí být zachována permeabilizace, které se dosáhne přidáním detergentu do barvicího pufru během celého následného barvení až do inkubace fluoroforu. Detekce intracelulárního antigenu pomocí průtokové cytometrie se jinak řídí výše uvedenými zásadami a postupy a může být přímá, nepřímá nebo přímá/nepřímá se zesílením signálu.
Sběr dat
Většina současných průtokových cytometrů je doplněna softwarem potřebným k získávání a transformaci signálů generovaných charakteristikami částic při průchodu každé buňky detektorem. Tyto softwarové programy obvykle obsahují součásti, které pomáhají při organizaci experimentu, což je funkce, která je obzvláště důležitá při analýze různých vzorků z více vzorků.
U vícebarevných experimentů je velmi důležité nastavit parametry pro kompenzaci, a to s ohledem na překrývání vlnových délek mezi spektry různých fluoroforů použitých v experimentu. Kompenzace kalibruje spektrum každého fluoroforu a umožňuje odečíst signály ze sousedních kanálů v důsledku překrývání spekter.
Pokud váš experiment nepřináší kvalitní výsledky, podívejte se na naši Průvodce řešením problémů průtokové cytometrie, kde najdete tipy na řešení běžných problémů.

Obrázek 2. Dvouparametrový graf průtokové cytometrie ukazuje, jak se charakteristiky rozptylu světla buněk používají k identifikaci buněčných populací, které jsou předmětem zájmu, zde podle jejich velikosti (přední rozptyl) a vnitrobuněčné složitosti (boční rozptyl). Brány nebo oblasti definované a použité uživatelem se pak používají k identifikaci subpopulací zájmu (zde červený ovál označuje pravděpodobnou životaschopnou populaci) pro cílenou analýzu.
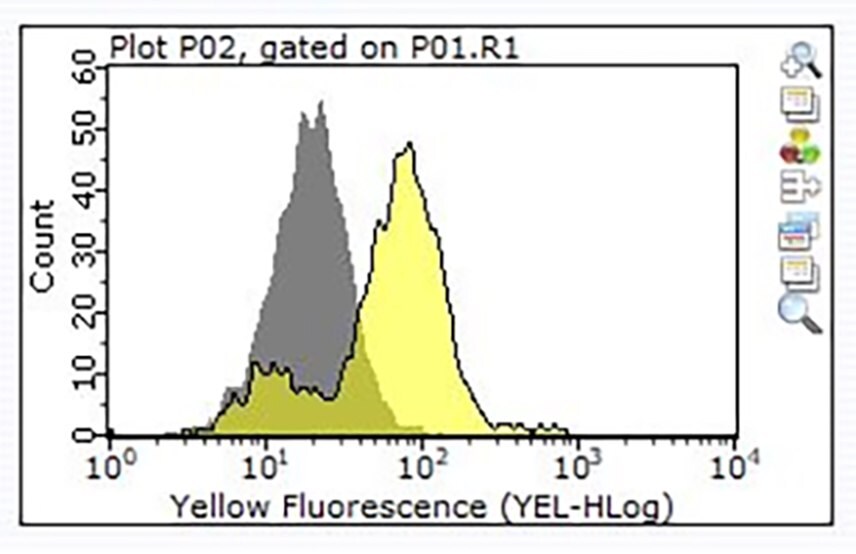
Obrázek 3. Barvení jednoho milionu buněk Raji provedené pomocí 1 μg produktu č. ZRB1564, Anti-CD24, klon 3N22 ZooMAb® králičí monoklonální (žlutý histogram) nebo ekvivalentního množství izotypové kontroly králičího IgG (šedý histogram), následované PE konjugovanou sekundární protilátkou oslí proti králičímu IgG.
Související produkty
Abyste mohli pokračovat ve čtení, přihlaste se nebo vytvořte účet.
Nemáte účet?