Úvod do protilátek: Interakce protilátka-Antigen
Když už víte, co je antigen a protilátka, podívejme se na jejich vzájemné působení. Sílu interakce mezi protilátkou a antigenem na jednotlivých antigenních místech lze popsat afinitou protilátky k antigenu. V rámci každého antigenního místa interaguje variabilní oblast "ramene" protilátky prostřednictvím slabých nekovalentních sil s antigenem na mnoha místech. Čím větší je interakce, tím silnější je afinita. Avidita je možná informativnějším měřítkem celkové stability nebo síly komplexu protilátka-antigen. Je řízena třemi hlavními faktory: afinitou k epitopu protilátky, valencí antigenu i protilátky a strukturním uspořádáním interagujících částí. Tyto faktory v konečném důsledku definují specifičnost protilátky, tj. pravděpodobnost, že se daná protilátka váže na přesný epitop antigenu.
Křížová reaktivita se týká vazby protilátky nebo populace protilátek na epitopy jiných antigenů. To může být způsobeno buď nízkou aviditou nebo specificitou protilátky, nebo tím, že více různých antigenů má identické nebo velmi podobné epitopy. Zkřížená reaktivita je někdy žádoucí, pokud chceme dosáhnout obecné vazby na příbuznou skupinu antigenů nebo pokud se pokoušíme o mezidruhové značení, když sekvence epitopů antigenu není během evoluce vysoce konzervovaná. Křížová reaktivita může vést k nadhodnocení nebo podhodnocení koncentrace antigenu a je problematická při imunoanalýze. Imunochemické techniky využívají extrémní specifičnosti na molekulární úrovni každého imunoglobulinu pro jeho antigen, a to i v přítomnosti vysokého množství kontaminujících molekul. Vícevalentnost většiny antigenů a protilátek umožňuje jejich interakci za vzniku precipitátu. Příklady experimentálních aplikací, které využívají protilátky, jsou Western blot, imunohistochemie a imunocytochemie, enzymová imunosorbční analýza (ELISA), imunoprecipitace a průtoková cytometrie. Každá z nich je podrobněji popsána v dalších částech této referenční příručky.
Kinetika interakce mezi protilátkou a antigenem
Podstata vazeb antigen-protilátka
Faktory ovlivňující reakce antigen-protilátka
Kinetika interakce antigenu s antigenem
Specifická asociace antigenů a protilátek závisí na vodíkových vazbách, hydrofobních interakcích, elektrostatických silách a Van der Waalsových silách. Ty jsou slabé, nekovalentní povahy, přesto mohou být některé asociace mezi antigenem a protilátkou poměrně silné. Stejně jako protilátky mohou být antigeny multivalentní, a to buď díky více kopiím stejného epitopu, nebo díky přítomnosti více epitopů, které jsou rozpoznávány více protilátkami. Interakce zahrnující multivalenci mohou vytvářet stabilizovanější komplexy; multivalence však může také vést ke sterickým obtížím, a tím snížit možnost vazby. Všechny vazby antigenů a protilátek jsou reverzibilní a řídí se základními termodynamickými principy jakékoli reverzibilní bimolekulární interakce:
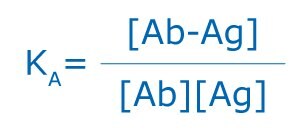
kde KA je afinitní konstanta, [Ab-Ag] je molární koncentrace komplexu protilátka-antigen a [Ab] a [Ag] jsou molární koncentrace neobsazených vazebných míst na protilátce (Ab), resp. antigenu (Ag).
Čas potřebný k dosažení rovnováhy závisí na rychlosti difuze a afinitě protilátky k antigenu a může se značně lišit. Afinitní konstanta pro vazbu protilátky a antigenu může zahrnovat široké rozmezí, které sahá od hodnot pod 105/mol až po hodnoty nad 1012/mol. Afinitní konstanty mohou být ovlivněny teplotou, pH a rozpouštědlem. Afinitní konstanty lze stanovit pro monoklonální protilátky, ale ne pro polyklonální protilátky, protože mezi polyklonálními protilátkami a jejich antigeny dochází k vícenásobnému vytváření vazeb. Kvantitativní měření afinity protilátek k antigenu lze provést pomocí rovnovážné dialýzy. Opakované rovnovážné dialýzy s konstantní koncentrací protilátky, ale měnící se koncentrací ligandu se používají k vytvoření Scatchardových grafů, které poskytují informace o valenci afinity a možné zkřížené reaktivitě.
Při navrhování experimentálních postupů je důležité rozlišovat mezi monoklonálními a polyklonálními protilátkami, protože tyto rozdíly jsou základem výhod i omezení jejich použití.
Příroda vazeb mezi antigenem a protilátkou
Spojovací místo protilátky se nachází v části F(ab) molekuly protilátky a je sestaveno z hypervariabilních oblastí těžkého a lehkého řetězce. Vazba mezi tímto místem a antigenem probíhá za následujících charakteristik a procesů:
- Vazby, které drží antigen na kombinačním místě každé protilátky, jsou nekovalentní, a proto mají reverzibilní charakter.
- Tyto vazby mohou být vodíkové, elektrostatické nebo Van der Waalsovy síly.
- Obvykle jsou pozorovány vícenásobné vazby, které zajišťují relativně těsnou vazbu mezi protilátkou a antigenem.
- Specifická vazba mezi antigenním determinantem na buňce (tzv. epitopem) a místem pro kombinaci antigenu (paratopem) na protilátce zahrnuje velmi malé části molekul, obvykle obsahující pouze několik aminokyselin.
- Tato místa jsou v reakci antigen-protilátka kritická, protože specifická vazba musí překonat odpuzování mezi oběma molekulami.
- Když se epitop dostane do kontaktu s paratopem, jsou k sobě nejprve přitahovány iontovými a hydrofobními silami.
- Tyto síly jim pomáhají překonat jejich hydratační energie a umožňují vytlačení molekul vody, když se epitop a paratop k sobě přibližují.
- Tato přitažlivost ještě zesílí, když se později uplatní Van der Waalsovy síly, které epitop a paratop ještě více přiblíží.
Faktory ovlivňující reakci antigen-protilátka
Reakci antigen-protilátka může ovlivňovat několik faktorů. Mezi nejčastější faktory patří:
Teplota
Optimální teplota pro reakci antigen-protilátka bude záviset na chemické povaze epitopu, paratopu a typu vazeb, které se podílejí na jejich interakci. Například tvorba vodíkových vazeb bývá exotermická. Tyto vazby jsou stabilnější při nižší teplotě a mohou být důležitější při práci se sacharidovými antigeny.
pH
Vliv pH na rovnovážnou konstantu komplexu antigen-protilátka leží v rozmezí pH 6,5 a 8,4. Vliv pH na rovnovážnou konstantu komplexu antigen-protilátka se projevuje v rozmezí pH 6,5 a 8,4. Pod pH 6,5 a nad pH 8,4 je reakce antigen-protilátka silně inhibována. Při pH 5,0 nebo 9,5 je rovnovážná konstanta stokrát nižší než při pH 6,5 - 7,0. Při pH 5,0 nebo 9,5 je rovnovážná konstanta stokrát nižší než při pH 6,5 - 7,0. Za extrémních podmínek pH může u protilátek dojít ke konformačním změnám, které mohou zničit komplementaritu s antigenem.
Iontová síla
Vliv iontové síly na reakci antigen-protilátka je zvláště důležitý v sérologii krevních skupin. Zde reakci významně ovlivňují sodné a chloridové ionty. Například v normálním fyziologickém roztoku se Na+ a Cl- shlukují kolem komplexu a částečně neutralizují náboje, což může narušit vazbu protilátky na antigen. To by mohlo být problematické při použití protilátek s nízkou afinitou. Je dobře známo, že při vystavení velmi nízkým iontovým silám se γ-globuliny shlukují a vytvářejí reverzibilní komplexy s lipoproteiny červených krvinek, což vede k jejich sedimentaci.
Pokračujte v poznávání protilátek s naším článkem o generaci protilátek.
Abyste mohli pokračovat ve čtení, přihlaste se nebo vytvořte účet.
Nemáte účet?