Strategie separacji i analizy pustych i wypełnionych kapsydów podczas produkcji wektorów wirusowych
Przegląd sekcji
- Oddzielanie pełnych kapsydów AAV od pustych i częściowo wypełnionych.
- Rozwój szablonu produkcyjnego do wychwytywania i oddzielania kapsydów
- Analytical Characterization of the AAV Empty/Full Capsid Ratio
- Analytical Characterization of the AAV Empty/Full Capsid Ratio
- Upstream Strategies for Reducing the Level of Empty and Partially Filled Capsids
- Trendy w projektowaniu kapsydów AAV wpływają na oczyszczanie

Puste kapsydy to kapsydy wirusowe, które nie zawierają genomu wektora, powstające podczas pakowania wirusów adenoasocjacyjnych (AAV) do wykorzystania jako wektory wirusowe w terapii genowej. Rola terapeutyczna pustych lub częściowo wypełnionych kapsydów nie jest w pełni zrozumiała. Uważa się, że puste kapsydy nie zapewniają żadnych korzyści terapeutycznych i mogą w rzeczywistości zwiększać wrodzoną lub adaptacyjną odpowiedź immunologiczną u pacjentów otrzymujących terapię genową.1 Są one uważane za zanieczyszczenia związane z produktem, które zgodnie z wytycznymi Amerykańskiej Agencji ds. Żywności i Leków (FDA),1 powinny być scharakteryzowane i monitorowane, ponieważ mogą mieć wpływ na bezpieczeństwo i skuteczność produktu.
Podczas gdy niektórzy producenci dążą do uzyskania 100% pełnych kapsydów w swoim procesie, inni akceptują niższe wartości procentowe. Dążenie do wyższego odsetka odzwierciedla obawy dotyczące bezpieczeństwa wysokich dawek wektorów AAV, w tym możliwych zaburzeń czynności wątroby.2 FDA nie ustaliła jeszcze wartości progowej dla odpowiedniego odsetka pełnych kapsydów, ponieważ wpływ kliniczny pustych lub częściowo wypełnionych kapsydów nie jest wystarczająco zdefiniowany. Dopuszczalny poziom pełnych kapsydów opiera się na doświadczeniu klinicznym. W związku z tym celem producentów powinno być utrzymanie stałego odsetka pełnych kapsydów we wszystkich fazach klinicznych, z naciskiem na solidne projekty badań przedklinicznych i klinicznych, aby zrozumieć tolerancję różnych poziomów czystości na pacjentów.
Aby zapoznać się z naszymi dostępnymi żywicami do chromatografii powinowactwa, odwiedź naszą stronę produktową tutaj.
Oddzielanie pełnych kapsydów AAV od pustych i częściowo wypełnionych
Chlorek cezu i ultrawirowanie oparte na jodiksanolu są powszechnie stosowane do przygotowań na małą skalę i procesów pierwszej generacji w środowisku akademickim. W produkcji na większą skalę, podejście oparte na chromatografii z wykorzystaniem wymiany anionów jest jednak bardziej pożądane ze względu na jego skalowalność.
Chromatografia jonowymienna była szeroko badana w celu oddzielenia pełnych od pustych lub częściowo wypełnionych kapsydów, ze względu na jej skalowalność, wysoką przepustowość i ograniczone przygotowanie próbki. Dzięki obecnym metodom można osiągnąć dobrą wydajność oddzielania pełnych i pustych kapsydów przy niskiej wydajności procesu lub osiągnąć wyższą ogólną wydajność procesu przy niskiej wydajności oddzielania. Nawet przy istniejącej wcześniej wiedzy na temat procesu, potrzebne są czasochłonne prace rozwojowe w celu optymalizacji parametrów, takich jak sole i dodatki procesowe. Kolejną komplikacją jest fakt, że AAV może wykazywać agregację w pewnych warunkach procesowych.
Rozwój szablonu produkcyjnego do wychwytywania i separacji kapsydów
Podczas gdy obecne podejścia do oczyszczania powinowactwa pojedynczego serotypu zwykle umożliwiają lepszą ekonomikę procesu, wyższą wydajność i wyższą redukcję zanieczyszczeń, mają one zastosowanie tylko do jednego konkretnego serotypu. Rozwój różnych rozwiązań powinowactwa zapewni więcej opcji separacji. Uniwersalne podejście do oddzielania pełnych od pustych lub częściowo pełnych kapsydów bez użycia powinowactwa również zapewniłoby większą elastyczność procesu. W tym scenariuszu, tylko jedno podejście musiałoby zostać zwalidowane, co mogłoby następnie dotyczyć wielu serotypów.
Obecnie opracowujemy nowe absorbery membranowe we współpracy z wiodącymi instytucjami akademickimi w tej dziedzinie. Ten jednorazowy proces typu plug-and-play, niezależny od serotypu, jest szczególnie odpowiedni dla niestandardowych serotypów w fazie odkrywania lub przedklinicznej do selekcji kandydatów. Membrany chromatograficzne charakteryzują się wysoką przepustowością objętościową ze względu na wielkość porów w zakresie 0,5-5 µm i niską wysokość złoża osiąganą dzięki stosom 3-16 warstw membran.3 Struktury żelowe to powłoki powierzchniowe, które pomagają zwiększyć wydajność. Powłoki są bardzo cienkie, aby zmniejszyć odległości dyfuzji i zachować głównie konwekcyjny ruch masy. W związku z tym technika ta nie jest ograniczona przez dyfuzję, a natężenie przepływu nie ma wpływu na zdolność wiązania.
Zmiana fazy stacjonarnej w ten sposób oferuje wiele korzyści, w tym wyższe natężenia przepływu do 10 ml/min.4 Umożliwia to przetwarzanie większych objętości próbek, przy jednoczesnym zmniejszeniu zużycia buforu. Ponieważ przepływ konwekcyjny jest możliwy przy większych średnicach porów, ograniczenia transferu masy są zmniejszone. Doskonała skuteczność wiązania jest możliwa dzięki bezpośredniemu dostępowi do grup funkcjonalnych i wysokim prędkościom przepływu.
Uniwersalny szablon produkcyjny dla AAV obejmuje nie tylko uniwersalny etap wychwytywania, ale także wymaga uniwersalnego podejścia do oddzielania pełnych od pustych kapsydów. Zarówno żywice, jak i absorbery membranowe oferują potencjał w zakresie separacji pustych i pełnych kapsydów. Małe cząsteczki żywicy oparte na chemii anionowymiennej, takie jak żywice Fractogel®, są obiecujące, gdy stosuje się je do gradientu hybrydowego w celu znalezienia równowagi między wydajnością procesu a skutecznością separacji pełnych i pustych kapsydów. Żywice te mogą być potencjalnie stosowane w podejściu wielokolumnowym w celu dalszej poprawy wydajności i produktywności.
Zastosowanie membran oferuje jednak znacznie większą elastyczność i potencjalnie większą produktywność w porównaniu z żywicami chromatograficznymi. Membrany Natrix® CH, z unikalną multimodalną chemią, która obejmuje kwas sulfonowy i grupy butylowe, mogą być stosowane do wychwytywania kapsydów AAV. Wraz z dalszą optymalizacją, może być możliwe oddzielenie pustych od pełnych kapsydów w jednym kroku. Projekt ten jest również częścią współpracy ze środowiskiem akademickim wspomnianym powyżej.
Powiązane produkty
Charakterystyka analityczna stosunku pustych/pełnych kapsydów AAV
Istnieje kilka możliwych podejść analitycznych do pomiaru stosunku pustych/pełnych kapsydów, w tym spektroskopia UV, która wykorzystuje stosunek A260 do A280 do określenia stosunku pustych/pełnych kapsydów. Metoda ta jest prosta, ale bardzo wrażliwa na obecność jakichkolwiek prostych składników, które absorbują światło przy 260 lub 280 nm. Preferowane jest połączenie ortogonalnych podejść, takich jak ilościowy PCR (qPCR) i ELISA; qPCR służy do ilościowego oznaczania genomu wirusa, a ELISA służy do ilościowego oznaczania cząstek wirusa. Stosunek pustych/pełnych kapsydów jest określany na podstawie porównania wyników. Inną metodą jest transmisyjna mikroskopia elektronowa, która zapewnia wysokiej jakości dane, ale wymaga specjalistycznego sprzętu i czasochłonnej analizy danych.
Chromatografia jonowymienna jest jedną z najczęściej stosowanych metod określania stosunku pustych/pełnych kapsydów; opiera się ona na różnicach w ładunku powierzchniowym w celu rozróżnienia między nimi.5 Rysunek 1 pokazuje separację pustych i pełnych kapsydów AAV8. Aby uzyskać stosunek pusty/pełny, piki reprezentujące pusty i pełny kapsyd są integrowane, a ich obszary piku porównywane. Wymiana anionowa jest metodą o wysokiej przepustowości, która jest łatwa do wykonania, generuje dane, które są łatwe do analizy i wymaga jedynie niewielkiej objętości próbki. Należy zauważyć, że metoda ta jest zależna od serotypu, co oznacza, że dla każdego serotypu należy opracować metodę specyficzną dla danego serotypu.
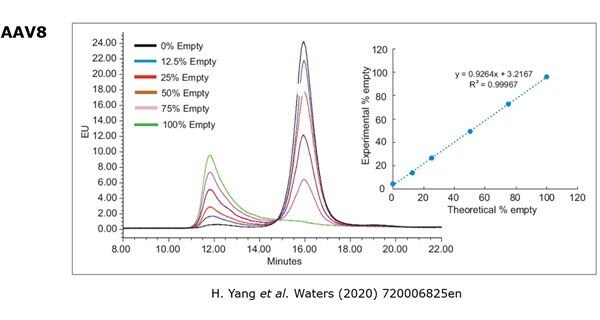
Rysunek 1.Analiza pustego/pełnego kapsydu metodą chromatografii anionowymiennej.
Analityczne ultrawirowanie jest powszechnie uznawane za złoty standard metody określania stosunku pustych/pełnych kapsydów AAV. Metoda ta oferuje wysoką rozdzielczość separacji, pozwalając na ilościowe oznaczenie pustych częściowych i pełnych kapsydów, gdzie częściowe kapsydy zawierają częściowe lub skrócone fragmenty genu lub kapsydu z zanieczyszczeniami z komórki gospodarza. Chociaż metoda ta jest niezależna od stereotypu, jest bardziej złożona w wykonaniu i wymaga większej objętości próbki niż metoda chromatografii anionowymiennej.
Nowe metody, które są obiecujące dla analizy pustych/pełnych kapsydów, obejmują chromatografię wykluczania wielkości i chromatografię anionowymienną z wielokątowym rozpraszaniem światła. Metody te oferują potencjał, aby być pojedynczym podejściem dla wszystkich zastosowań, dostarczając informacji na temat stosunku pełny/pusty, miana kapsydu i poziomu agregacji na linii.
Inicjatywa ta jest związana z naszym programem z National Institute for Innovation in Manufacturing Biopharmaceuticals (NIIMBL) skoncentrowanym na opracowaniu mikroprzepływowego urządzenia wykrywającego w jednym, przenośnym formacie urządzenia. Kolejną innowacyjną koncepcją opracowywaną we współpracy z NIIMBL jest mikroprzepływowe urządzenie wykrywające w jednym, przenośnym formacie. Umożliwiłoby to określenie w pełni pustych kapsydów na pojedynczym, przenośnym urządzeniu w prostym formacie.
Strategie upstream w celu zmniejszenia poziomu pustych i częściowo wypełnionych kapsydów
.Nowe podejścia upstream mogą pomóc zmniejszyć odsetek pustych i częściowo wypełnionych kapsydów, w tym ulepszenia systemów produkcyjnych opartych na HEK i wykorzystanie systemów ekspresji bakulowirusów, w których odsetek pełnych kapsydów jest ogólnie wyższy pod koniec zbioru. Podczas gdy wykorzystanie komórek owadzich może prowadzić do większej liczby pełnych kapsydów, będą również występować wyższe poziomy zanieczyszczeń paszy, które następnie wywierają presję na dalsze etapy oczyszczania.
Trendy w projektowaniu kapsydów AAV wpływają na oczyszczanie
Historycznie serotypy AAV od 1 do 10 były używane jako wektory wirusowe. Hybrydowe serotypy pojawiają się obecnie dzięki nowatorskiej konstrukcji kapsydu, sztucznej inteligencji i uczeniu maszynowemu, oferując wyższą wydajność transdukcji niż obecnie dostępne serotypy i umożliwiając nowe strategie celowania. Na przykład nowe serotypy, takie jak AAV-DJ, AAV-DJ/8, rh10 i AAV-PHP, mogą być ukierunkowane na centralny układ nerwowy.
Potrzeba oddzielenia pustych/częściowych kapsydów pozostanie, zapewniając, że kryteria uwalniania kierujące bezpieczeństwem pacjentów mogą zostać osiągnięte. Pożądane jest przejście na szablonowe procesy chromatograficzne, chociaż prawdopodobnie będzie to odbywać się poprzez indywidualne podejście w zależności od złożoności separacji wymaganej dla tych nowych serotypów.
Aby uzyskać więcej informacji, zapraszamy do obejrzenia naszego webinarium na żądanie na temat technik chromatograficznych dla oczyszczania w dół strumienia tutaj.
Jeśli szukasz więcej informacji na temat naszej oferty downstream, odwiedź naszą stronę aplikacji downstream tutaj.
Referencje
Zastrzeżenie
Żywica Fractogel® nie może być stosowana w komercyjnych procesach produkcyjnych do separacji pustych kapsydów AAV przeznaczonych do użytku terapeutycznego u ludzi bez zgody organu regulacyjnego. nie może być używana w komercyjnych procesach produkcyjnych do oddzielania pustych i pełnych kapsydów AAV, które są przeznaczone do użytku terapeutycznego u ludzi i których użycie zostało zatwierdzone przez organ regulacyjny do sprzedaży komercyjnej, bez uprzedniej zgody właściciela EP 2 277 996 (Genzyme Corporation, Cambridge, MA) i/lub US 8,137,948 (Genzyme Corporation, Framingham, MA) i/lub US 9,528,126 (Genzyme Corporation, Cambridge, MA). Zakup stanowi zgodę nabywcy na to, że produkt nie może być wykorzystywany w komercyjnych procesach produkcyjnych do oddzielania pustych i pełnych kapsydów AAV, które to kapsydy AAV są przeznaczone do użytku terapeutycznego u ludzi i których użycie zostało zatwierdzone przez organ regulacyjny do sprzedaży komercyjnej.
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?