Kannabinoidowe CRM: Dokładność testów i identyfikowalność
Sarah Aijaz, Sr. R&D Manager, Reference Materials, Zoe Ruan, Principal Scientist, Sunil Badal, Senior Scientist, Uma Sreenivasan, Head of Reference Materials R&D
Merck
Abstrakt
Materiały referencyjne odgrywają kluczową rolę w przepływach pracy związanych z konopiami indyjskimi. Wyniki są tylko tak dokładne, jak materiał referencyjny. Opracowaliśmy portfolio certyfikowanych materiałów referencyjnych kannabinoidów (CRM) do stosowania w kalibracji i amp; kwantyfikacji, badaniach przydatności systemu i badaniach jakościowych.
Wprowadzenie
Zainteresowanie kwantyfikacją kannabinoidów lub testowaniem mocy marihuany i konopi stale rośnie wraz z rosnącą komercjalizacją suplementów diety z konopi indyjskich i produktów rekreacyjnych. Podczas gdy większość stanów USA zalegalizowała marihuanę do użytku medycznego i kilka do użytku rekreacyjnego, nadal pozostaje ona nielegalna na szczeblu federalnym i jest klasyfikowana jako substancja z harmonogramu 1. Uprawa konopi w Stanach Zjednoczonych została zalegalizowana na szczeblu federalnym na mocy ustawy U.S. Agricultural Improvement Act z 2018 r., znanej również jako 2018 Farm Bill. Zgodnie z ostatecznymi przepisami Departamentu Rolnictwa Stanów Zjednoczonych (USDA) dotyczącymi produkcji konopi, opublikowanymi 19 stycznia 2021 r., całkowita zawartość tetrahydrokannabinolu (THC) w materiale roślinnym w przeliczeniu na suchą masę musi wynosić mniej niż 0,3%, aby można go było legalnie zdefiniować jako konopie. Całkowita zawartość THC jest traktowana jako suma Δ-9 THC i jego biosyntetycznego prekursora, kwasu tetrahydrokannabinolowego (THCA), ponieważ THC jest produktem degradacji THCA po jego dekarboksylacji. Producent konopi musi odrzucić całą partię, jeśli pobrany materiał roślinny zawiera więcej niż 0,3% THC, co może mieć tragiczne konsekwencje finansowe. Produkcja materiału roślinnego zawierającego więcej niż 1% całkowitego THC jest definiowana jako zaniedbanie i może skutkować zawieszeniem lub cofnięciem licencji USDA producenta na uprawę konopi. Konsekwencje te podkreślają znaczenie dokładnych testów analitycznych kannabinoidów. Jednak ostateczna zasada uznaje znaczenie zmienności analitycznej i wymaga od laboratoriów testujących zgłaszania niepewności pomiaru (MU) związanej z wynikami testu THC, aby umożliwić uwzględnienie MU w "dopuszczalnym poziomie THC w konopiach".1
W tymczasowych przepisach końcowych (IFR), Agricultural Marketing Service (AMS) poprosił o informacje na temat potencjalnych wymagań dla laboratoriów testujących konopie w celu uzyskania akredytacji ISO/IEC 17025. Wymóg ten nie został jednak uwzględniony w ostatecznej wersji przepisów ze względu na komentarze wskazujące na niewystarczające obecnie dostępne możliwości laboratoryjne, aby pomieścić wszystkie potrzebne testy konopi. Laboratoria muszą spełniać określone standardy wydajności i stosować metody testowe, które są odpowiednie do celu, jednak obecnie nie ma federalnego procesu zatwierdzania laboratoriów, a wymagania stanowe są bardzo zróżnicowane. Dozwolone metodologie testów analitycznych to GC-FID lub HPLC z detekcją UV lub MS, a metody muszą spełniać standardowe wymagania AOAC 2019.003.2 AOAC opublikował oficjalną metodę 2018.11 do ilościowego oznaczania kannabinoidów w materiałach roślinnych, która przeszła rygorystyczny proces zatwierdzania i jest akceptowana jako wysoce wiarygodna metoda.3 Farmakopea Stanów Zjednoczonych (USP) zauważyła potrzebę zwiększonej kontroli jakości i zharmonizowanych praktyk w testowaniu konopi indyjskich do celów medycznych i opublikowała ważne uwagi dotyczące atrybutów jakości, aby pomóc w wypełnieniu tych luk.4 NIST oferuje program zapewnienia jakości konopi indyjskich podobny do testu biegłości, aby pomóc laboratoriom ocenić ich porównywalność i kompetencje w zakresie testowania.5 Nawet z tymi wytycznymi i zasobami na miejscu, branża uznała ciągły problem niespójnych wyników uzyskanych z różnych laboratoriów.
Dokładność standardów kalibracji laboratorium testowego jest krytycznym czynnikiem, który bezpośrednio wpływa na dokładność wyników testu. Laboratoria muszą wyprodukować lub zakupić odpowiedni surowiec lub materiał referencyjny na bazie roztworu do wykorzystania jako kalibrator. Dostępność certyfikowanych materiałów referencyjnych kannabinoidów (CRM) pozwala laboratoriom testowym na tworzenie opłacalnych kalibratorów wewnętrznych, identyfikowalnych z CRM, przyczyniając się tym samym do wyższego poziomu dokładności i odtwarzalności testów.
ISO 17034 - specyficzne dla producentów materiałów referencyjnych i ISO/IEC 17025 - specyficzne dla laboratoriów testowych zapewniają standaryzację produkcji i testowania CRM. Uważa się, że CRM mają najwyższy poziom dokładności i identyfikowalności z jednostką miary SI dla wszystkich materiałów wytwarzanych przez producentów akredytowanych przez ISO.6,7 Istnieje wybór wzorców referencyjnych związanych z konopiami indyjskimi oferowanych przez USP do użytku medycznego. Nie ma jednak wzorców referencyjnych kannabinoidów wytwarzanych przez jakikolwiek krajowy instytut metrologiczny. Jednak materiały referencyjne dla roślin i oleju konopnego są obecnie opracowywane przez NIST.5
Zaprojektowaliśmy i wyprodukowaliśmy portfolio materiałów CRM do oznaczania kannabinoidów w celu wsparcia branży testowania konopi indyjskich. Produkty te są oferowane jako pojedyncze lub wielokrotne anality rozpuszczone w odpowiednim rozcieńczalniku i zapakowane w bursztynowe, szczelnie zamknięte ampułki. Aby zapewnić stabilność analitów podczas przechowywania i transportu, wprowadzono odpowiednie kontrole obsługi i procesu. Stężenie każdego analitu jest certyfikowane zgodnie z normami ISO 17034 i ISO/IEC 17025. Niepewność stężenia jest obliczana i zgłaszana wraz z certyfikowanym stężeniem w załączonym certyfikacie analizy (CoA). Laboratoria testujące konopie indyjskie powinny propagować tę wartość nierozszerzonej niepewności w obliczeniach niepewności własnych metod.
Produkcja i certyfikacja CRM kannabinoidowych
Surowce kannabinoidowe użyte do przygotowania CRM Cerilliant® zostały zsyntetyzowane we własnym zakresie i certyfikowane zgodnie z wcześniej ustalonym planem testów zaprojektowanym zgodnie z normami ISO 17034 i ISO/IEC 17025. Tożsamość każdego kannabinoidu została zweryfikowana za pomocą 1H-NMR i wysokorozdzielczej chromatografii cieczowej ze spektrometrią mas (LC-MS). Potencjał lub ułamek masowy każdego surowca został przypisany jako współczynnik czystości bilansu masy (MBPF), obliczony przez odjęcie masy zanieczyszczeń od masy analitu przy użyciu Wzoru 1. Zanieczyszczenia zostały określone za pomocą szeregu technik uwzględniających te, które są lotne, nieorganiczne i organiczne. Resztkowa zawartość wody została określona za pomocą kulometrii Karla Fischera. Podczas gdy inne pozostałości lotne określono za pomocą chromatografii gazowej headspace z detekcją jonizacji płomieniowej (HS-GC-FID), resztkową zawartość nieorganiczną określono za pomocą pozostałości po zapłonie (popiół siarczanowy).
Zanieczyszczenia organiczne określono za pomocą wysokosprawnej chromatografii cieczowej z detekcją ultrafioletową (HPLC-UV) i podano jako średnią z dwóch ortogonalnych metod. Ortogonalną selektywność obu metod ustalono za pomocą różnych chromatograficznych faz stacjonarnych i ruchomych. GC-FID zastosowano jako technikę potwierdzającą do analizy zanieczyszczeń organicznych tam, gdzie było to właściwe. W niektórych przypadkach ilościowy 1H-NMR był również stosowany jako technika potwierdzająca dla MBPF.
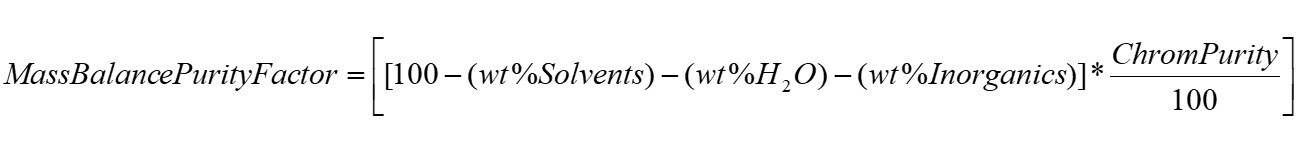
Równanie 1.Obliczanie współczynnika czystości bilansu masy.
Gdzie:
wt% Solvents = resztkowa zawartość rozpuszczalnika z niepewnością, uOVI
wt% H2O = resztkowa zawartość wody z niepewnością, uKF
wt% Inorganics = resztkowa zawartość nieorganiczna z niepewnością, uROI
ChromPurity = czystość chromatograficzna z niepewnością, ucp
Przeprowadzono badania formulacji w celu określenia odpowiednich technik postępowania, warunków przechowywania, odpowiednich stężeń i rozcieńczalników dla proponowanych produktów. Ostateczne projekty CRM zostały oparte na wynikach badań formulacji. Każdy roztwór został przygotowany poprzez pomiar grawimetryczny analitu(ów) i rozcieńczalnika ze stężeniem określonym przez Wzór 2, przy użyciu rzeczywistej zmierzonej masy, dostosowania czystości analitu(ów), zmierzonej masy roztworu i gęstości czystego rozcieńczalnika w temperaturze 20 °C. W przypadku lepkich, szklistych lub trudnych w obsłudze surowców sporządzono roztwór podstawowy i zweryfikowano analitycznie przed ostatecznym rozcieńczeniem. Wszystkie pomiary masy są identyfikowalne z Międzynarodowym Układem Jednostek Miar (SI) za pomocą wykwalifikowanych i skalibrowanych wag analitycznych i zostały podane w oparciu o konwencjonalną podstawę ważenia w powietrzu. Masa każdego roztworu została przeliczona na objętość poprzez podzielenie masy przez gęstość roztworu. Pomiary gęstości zostały wykonane na gęstościomierzu i są identyfikowalne z wzorcami wyższego rzędu poprzez kalibrację. Przygotowane stężenie każdego analitu jest podawane w jednostkach masy na objętość, z rozszerzoną niepewnością i określonym przedziałem ufności. Roztwory dozowano do bursztynowych ampułek o objętości nie mniejszej niż 1 ml i zamykano płomieniowo w atmosferze argonu.

Równanie 2.Certyfikowane obliczanie stężenia dla grawimetrycznie przygotowanego CRM.
Gdzie:
C = Certyfikowana Wartość Własności, stężenie analitu w roztworze w jednostkach masa/objętość
mv+a = masa analitu + fiolka
mv = masa pustej fiolki
mf+s = masa kolby + rozpuszczalnik
mf = masa pustej kolby
d = gęstość roztworu
p = korekta czystości, 100/współczynnik czystości wagi masowej (dla analitu)
U = przypisana łączna rozszerzona niepewność pomiaru
Stężenie, jednorodność i czystość każdego CRM zweryfikowano za pomocą testów analitycznych HPLC-UV. Zapieczętowane ampułki zostały wybrane do testów z całej partii w oparciu o losowy ważony warstwowy plan pobierania próbek, z wyższym odsetkiem próbek pobranych w krytycznych punktach procesu. Stężenie zostało zweryfikowane przez porównanie z niezależnie przygotowanym roztworem kalibracyjnym i obliczone jako średnia z powtórzonych analiz próbek. Jednorodność w obrębie ampułek i pomiędzy ampułkami została zweryfikowana poprzez względne odchylenie standardowe powtórzonych analiz próbek. Kryteria akceptacji dokładności i jednorodności obejmowały uwzględnienie niepewności związanej z pomiarem analitycznym oraz zmienności związanej z transferem i utratą parowania podczas przygotowywania próbek do analizy.
Krótkoterminową stabilność tranzytową ustalono na podstawie badań naprężeń temperaturowych przeprowadzonych w zamrażarce (-25 do -10 °C), lodówce (2-8 °C), temperaturze pokojowej (15-30 °C) i temperaturze stresu (40 °C +/-2 °C). Jedna ampułka każdego roztworu wzorcowego została usunięta z każdych warunków przechowywania w określonych punktach czasowych i przeniesiona do zamrażarki do czasu analizy. Ampułki przechowywane w podwyższonej temperaturze oceniano pod kątem czystości i/lub stężenia za pomocą HPLC-UV.
Długoterminową stabilność CRM oceniano przez 14 miesięcy po ich wyprodukowaniu. Dokonano tego przy użyciu analizy HPLC-UV do badań czystości i stężenia roztworu w czasie rzeczywistym. Badania te są następnie przeprowadzane przez cały okres trwałości produktu.
Wyniki i dyskusja
ISO definiuje materiał referencyjny (RM) jako materiał, który jest jednorodny, stabilny i odpowiedni do zamierzonego zastosowania pomiarowego. CRM musi spełniać dodatkowe wymagania w stosunku do RM. Metody charakteryzacji CRM muszą być metrologicznie poprawne i identyfikowalne z jednostką miary certyfikowanej wartości właściwości.8 Wytyczne ISO dają producentom CRM pewną elastyczność w zakresie sposobu spełnienia tych wymagań.
W rezultacie proces certyfikacji może się znacznie różnić w zależności od producenta, od przypisania siły działania na podstawie prostej czystości chromatograficznej do kompleksowego podejścia MBPF. Laboratoria testujące konopie indyjskie muszą mieć to na uwadze i dokonać przeglądu certyfikatu analizy CRM (CoA), aby upewnić się, że jest on odpowiedni do zamierzonego zastosowania. Tabela 1 pokazuje możliwe pułapki związane ze stosowaniem wyłącznie czystości chromatograficznej. Czystość chromatograficzna kannabinolu wynosi 99,5%, ale moc przypisana mu przez MBPF wynosi 96,0% - ze względu na obecność resztkowego rozpuszczalnika i wody.
Oprócz metody certyfikacji, każda CoA powinna zawierać dane potwierdzające stabilność podczas transportu i długoterminową w okresie trwałości produktu. Rysunek 1A pokazuje przykład badania naprężeń temperaturowych dla niestabilnej prototypowej formulacji, gdzie widzimy spadek stężenia wraz ze wzrostem temperatury i czasu przechowywania. Ostateczna stabilna formulacja produktu C-218 została opracowana poprzez zoptymalizowany dobór rozcieńczalnika, obsługę materiałów i kontrolę procesu formulacji. Rysunek 1B pokazuje, że stężenia wszystkich analitów w C-218 pozostają stabilne w wielu temperaturach przechowywania do czterech tygodni, z degradacją obserwowaną tylko w próbkach przechowywanych w temperaturze 40 °C. Rysunek 1C pokazuje te same dane przyspieszonej stabilności wykreślone jako wykres liniowy dla dwóch reprezentatywnych analitów, CBDA i THCA-A, z dodatkową stabilnością w czasie rzeczywistym pokazaną do 6 miesięcy. Ciągła stabilność w czasie rzeczywistym jest oceniana przez cały okres trwałości produktu.



Rysunek 1.Wykresy słupkowe przedstawiające badania stresu temperaturowego prototypu (A) i sfinalizowanej (B) kwaśnej mieszaniny kannabinoidów ze słupkami pokazującymi zmianę stężenia związaną z czasem przechowywania w różnych temperaturach: fz: zamrażarka (-25 do -10 °C), R: lodówka (2-8 °C), RT: temperatura pokojowa (15-30 °C) i 40 (±2) °C. Dolny wykres (C) przedstawia zmianę stężenia CBDA i THCA-A w ciągu sześciu miesięcy w nr kat. C-218 przechowywanych w różnych temperaturach.
A CRM CoA powinna raportować metodę zastosowaną do określenia niepewności pomiaru. Rysunek 2 przedstawia przykładowy diagram rybiej ości dla źródeł niepewności związanych z certyfikowanym stężeniem grawimetrycznie przygotowanego roztworu wzorca. Wzór 3 przedstawia obliczenia propagacji niepewności. Metoda zastosowana do obliczenia niepewności została ustalona zgodnie z ISO 17034 i ISO Guide 35 poprzez identyfikację zmiennych procesu produkcyjnego i ryzyka w połączeniu z analizą statystyczną. Niepewność jest wyrażona jako niepewność rozszerzona w przybliżonym 95% przedziale ufności przy użyciu współczynnika pokrycia k=2. Obejmuje ona niepewność współczynnika czystości, gęstości materiału, wagi, procedury ważenia, jednorodności wzorca roztworu i stabilności. Niepewność certyfikowanego stężenia jest określona w CoA w kategoriach masy na objętość.

Rysunek 2.Diagram Fishbone składowych niepewności pomiaru dla certyfikowanego stężenia.
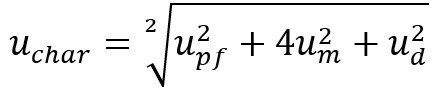
Równanie 3.Obliczenie niepewności dla certyfikowanego stężenia CRM z uwzględnieniem warunków jednorodności i stabilności.
ucert = niepewność standardowa certyfikowanej wartości właściwości
uchar = niepewność standardowa przygotowania wzorca roztworu i obejmuje upf dla charakterystyki współczynnika czystości bilansu masy analitu (pf), um dla pomiarów masy oraz ud dla gęstości rozpuszczalnika.
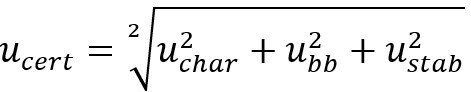
ubb = niepewność standardowa jednorodności między butelkami
ustab = niepewność standardowa stabilności
Określenie wartości niepewności dla CRM obejmuje badania techniczne dotyczące wszystkich aspektów procesu przygotowania wzorca roztworu, w tym pomiaru masy, pomiaru gęstości, weryfikacji, jednorodności i stabilności. Badania obejmują powtarzalne pomiary w różnych warunkach procesowych i ustalają standardowe niepewności dla pomiarów gęstości i masy. Badania zapewniają również zatwierdzone kontrole procesu ważenia i dozowania. Wkład niepewności jednorodności jest oceniany poprzez analizę statystyczną danych dokładności stężenia dla próbek pobranych w krytycznych punktach czasowych podczas dozowania danej partii. Niepewność stabilności jest oceniana na podstawie danych dotyczących stabilności w czasie rzeczywistym lub w warunkach stresu temperaturowego.
CRM mogą być wykorzystywane do identyfikacji, oznaczania ilościowego, przydatności systemu i kontroli metod. Rysunek 3 pokazuje przykład schematu rozcieńczania CRM w celu uzyskania standardu zawierającego siedemnaście kannabinoidów. Może to być początkowo wykorzystane jako narzędzie przesiewowe do oceny obecności lub braku kannabinoidów w próbkach. Po zidentyfikowaniu interesujących kannabinoidów, mieszaninę można rozcieńczyć do krzywej kalibracyjnej obejmującej oczekiwany zakres stężeń składników i wykorzystać do oznaczenia ilościowego. Alternatywnie, do przygotowania krzywych kalibracyjnych można użyć CRM pojedynczych analitów. Przykładowe chromatogramy HPLC-UV mieszaniny 17-kannabinoidów przygotowanej z 5 CRM (nr kat. C-218, C-219, C-153, C-154 i C-171) i ekstraktu z pąków konopi porównano na Rysunku 3.

Rysunek 4 ilustruje użycie naszej mieszanki Hemp Compliance Mix (C-217) jako testu przydatności systemu w celu zapewnienia skuteczności metody wykrywania THC na maksymalnym dozwolonym poziomie 0,3%. Oddzielny roztwór zawierający 5 µg/ml kannabidiolochinonu (CBDQ) został wykonany przy użyciu tej samej metody. CBDQ jest jednym z utleniających degradantów CBD. Nałożone na siebie chromatogramy pokazują podstawową separację THC i CBDQ za pomocą tej metody. Jeśli inne kannabinoidy lub zanieczyszczenia koeluują z THC, wystąpią błędy w oznaczeniu ilościowym. Dlatego ważne jest rutynowe sprawdzanie wydajności metody przy użyciu mieszaniny opracowanej specjalnie do tego celu, takiej jak zilustrowana na Rysunku 4.

Rysunek 4.Nałożenie chromatogramów HPLC-UV mieszaniny zgodności konopi C-217 i próbki zawierającej CBDQ pokazujące rozdzielczość między THC i CBDQ.
Wnioski
Opracowaliśmy CRM poszczególnych kannabinoidów, jak również mieszanek. Mogą one być wykorzystywane do profilowania mocy zarówno konopi, jak i marihuany. W szczególności, nasza mieszanka zgodności z konopiami została opracowana w celu uproszczenia przygotowania standardów do analizy zawartości THC w konopiach. Stosując rygorystyczne kontrole procesu i badania formuły, jak opisano tutaj, sformułowaliśmy stabilne mieszaniny kannabinoidów. Nasze zoptymalizowane surowce i procesy pakowania chronią kannabinoidy przed utlenianiem, tworząc w ten sposób CRM o długoterminowej stabilności. Ze względu na zmienność metod testowania i akredytacji w różnych laboratoriach, stosowanie dokładnych, identyfikowalnych i odpowiednio certyfikowanych CRM ma kluczowe znaczenie.
Rozwiązania wieloskładnikowe
Materiały
Referencje
Zaloguj się lub utwórz konto, aby kontynuować.
Nie masz konta użytkownika?