Interazioni tra proteine e acidi nucleici
Le proteine sono delle molecole chiave per la cellula e sono responsabili di una miriade di attività biologiche che le cellule svolgono per funzionare e sopravvivere. È interessante notare che un insieme diversificato di proteine interagisce anche con il DNA. Il DNA nei nostri cromosomi si avvolge intorno alle proteine in una struttura strettamente impacchettata chiamata cromatide. Questi complessi DNA-proteine hanno la funzione di impacchettare e compattare il DNA all'interno del nucleo. Sono stati sviluppati strumenti e tecniche molecolari potenti, in grado di isolare queste strutture proteine-DNA e altri complessi proteici che legano il DNA per sottoporle ad applicazioni successive.
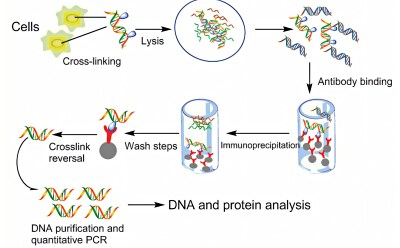
Immunoprecipitazione
Con l’immunoprecipitazione, in cui si utilizzano anticorpi altamente specifici per le proteine che legano l’RNA e il DNA (ad es. fattori di trascrizione), gli scienziati possono studiare la regolazione dei pathway molecolari e comprendere meglio la funzione dei geni, sia nei tessuti sani che in quelli malati.
Attualmente disponiamo di diverse tecniche e metodiche progettate per lo studio delle interazioni proteina-RNA e proteina-DNA e per le successive analisi. Ad esempio, i saggi di immunoprecipitazione della cromatina (ChIP) vengono spesso utilizzati per studiare le interazioni tra fattori di trascrizione e DNA per studi di espressione genica e di modificazione epigenetica. I saggi di precipitazione dell'RNA (RIP), invece, sono comunemente usati per studiare le proteine che si legano a mRNA, RNA non codificanti, miRNA e RNA virali. Un aspetto critico comune agli studi di immunoprecipitazione è quello della specificità e/o della disponibilità dell'anticorpo per la proteina di interesse. Per ovviare a questo problema, i ricercatori si affidano alla tecnologia delle proteine ricombinanti che consentono di esprimere delle proteine modificate con tag specifici, come il tag emoagglutinina (HA), riconosciuti con elevata specificità dall'anticorpo appropriato.
Fate una ricerca tra i numerosi documenti disponibili: schede tecniche, certificati e documentazione tecnica.
Saggio di ligazione di prossimità
Gli scienziati che usano le tecniche per lo studio delle interazioni proteina-DNA hanno messo a punto nuovi strumenti e metodi per investigare anche le interazioni proteina-proteina. Ilsaggio di ligazione di prossimità (PLA), assicurando specificità e sensibilità elevate, consente di rivelare le proteine endogene, le modificazioni di proteine e le eventuali interazioni proteiche in situ. In modo analogo alle tecniche di immunoprecipitazione, il saggio PLA sfrutta anticorpi primari altamente specifici per riconoscere le due proteine di interesse. Tuttavia, in questo saggio gli anticorpi primari vengono legati da anticorpi secondari marcati con degli oligonucleotidi modificati che fungono da sonda per PLA. Solo se entrambe le proteine sono presenti e vicine tra loro, gli oligo di ibridazione, fungendo da ponte, uniscono le sonde per PLA. A questo punto, l'aggiunta di una ligasi consente di generare un DNA circolare completo che va incontro a cicli ripetitivi di amplificazione (rolling-circle amplification o RCA) grazie all’aggiunta di una DNA polimerasi, generando un segnale notevolmente amplificato collegato alla sonda per PLA. La scelta della tecnica più adatta per lo studio delle interazioni tra proteine e acidi nucleici dipende in buona parte dalle applicazioni a valle che interessano il ricercatore.
Articoli tecnici correlati
- Learn how Proximity Ligation Assay technology works and how the protein-protein interaction control kit can confirm in situ detection of EGF-induced EGFR-HER2 dimerization.
- We synthesize peptides up to 200 amino acids in length using state of the art solid support chemistries and purify peptides using HPLC. A variety of purity levels, scales of synthesis and extensive modifications are available.
- RNA Immunoprecipitation (RIP) is an essential method for analyzing proteins that interact with and modify the function of mRNAs, small RNAs, viral RNAs, or lncRNAs.
- Duolink® PLA Multicolor technology and the quantification of protein-protein interactions in fixed tissues and cells.
- Support information including tips and tricks, frequently asked questions, and basic troubleshooting.
- Visualizza tutto (37)
Protocolli correlati
- This protocol describes how to perform immunofluorescent detection of proteins in cells and tissue.
- Duolink® kits use in situ PLA®, a proximity ligation assay technology, to accurately and objectively quantify individual proteins, and their interactions and modifications in unmodified cells and tissue.
- The video follows the simple and straightforward procedure that allows you to detect, quantify and obtain cell localization of protein interactions and their modifications in a single experiment.
- This page shows how to purify or remove DNA-binding proteins with Heparin Sepharose High Performance, Heparin Sepharose 6 Fast Flow, Capto Heparin from Cytiva.
- Visualizza tutto (16)
Per consultare altri articoli e protocolli
Come possiamo aiutarvi
Per qualunque domanda, non esitate a inviare una richiesta di assistenza
o a chiamare il nostro Servizio Clienti:
Email custserv@sial.com
telefono +1 (800) 244-1173
Altre risorse
- Chromatogram Search
Use the Chromatogram Search to identify unknown compounds in your sample.
- Strumenti di calcolo e app
Strumenti e risorse scientifiche online per la chimica analitica, le life science, la sintesi chimica e la scienza dei materiali.
- Customer Support Request
Assistenza clienti inclusa assistenza per ordini, prodotti, account e problemi tecnici del sito web.
- FAQ
Explore our Frequently Asked Questions for answers to commonly asked questions about our products and services.
Per continuare a leggere, autenticati o crea un account.
Non hai un Account?