Citologia e citodiagnosi
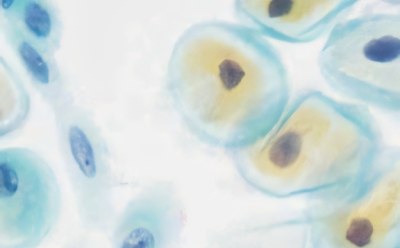
La citologia consiste nello studio della struttura e della funzione delle cellule, mentre per citodiagnosi si intende l'uso della citologia come strumento diagnostico. La citodiagnosi si avvale di colorazioni e protocolli ben consolidati e altamente specifici che facilitano l'identificazione di anomalie cellulari al microscopio. La citodiagnosi umana è una tecnica che si occupa dell'esame dei campioni per identificare la presenza di cellule tumorali o precancerose; comprende due grandi aree della citologia, quella ginecologica e quella non ginecologica.
Categorie in evidenza
Offriamo una selezione completa di reagenti, strumenti e vetreria per microscopia Corning®, BRAND®, PELCO® e di altri affidabili marchi specializzati, utilizzabili per la ricerca e le analisi cliniche.
Un conteggio delle cellule accurato e riproducibile è fondamentale per le colture cellulari e i successivi saggi ed esperimenti cellulari. Un contatore Coulter palmare garantisce accuratezza e riproducibilità massime nelle conte cellulari in pochi secondi. Gli emocitometri monouso riducono le probabilità di infezione negli ambienti a rischio.
I campioni in citologia
Nella citodiagnosi, le cellule vengono estratte dalla massa tissutale o dal fluido campione, vengono quindi trasferite su un vetrino citologico, colorate, esaminate e valutate. Durante questi passaggi l'architettura del tessuto originale diventa irriconoscibile e non può quindi essere di aiuto nel processo di valutazione. I materiali dei campioni, come espettorato, urina, versamenti delle cavità corporee e materiale di lavaggio, vengono centrifugati e il sedimento viene quindi strisciato su un vetrino da microscopio. Il materiale ottenuto da mammelle, tiroide, linfonodi, prostata, liquido cerebrospinale e altre sedi tramite agobiopsia (FNAB), semplice o assistita da immagini, viene strisciato con cura sui vetrini. A seconda del metodo di colorazione, gli strisci vengono fissati immediatamente (colorazione di Papanicolaou) o asciugati completamente all'aria prima della colorazione ematologica o di altri tipi di colorazione.
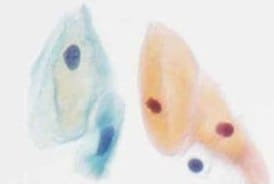
La fissazione in citologia
Per una diagnosi citologica esatta è fondamentale la perfetta fissazione del campione. I campioni devono essere fissati immediatamente dopo la raccolta per evitare che le cellule si secchino e si contraggano. Una fissazione immediata mantiene le caratteristiche strutturali del campione, garantendo l’accuratezza delle colorazioni standard o differenziali. Se i campioni non vengono fissati in tempi rapidi, si possono formare artefatti in grado di interferire con la diagnosi. Il metodo classico di fissazione prevede l'immersione del vetrino in etanolo al 96% per 30 minuti. Un metodo più efficiente consiste nel fissare le cellule con un fissativo spray, di solito una soluzione acquoso-alcolica contenente glicole polietilenico (PEG). I fissativi spray sono adatti per tutti i tipi di materiali citologici colorati con il metodo Papanicolaou.
Colorazioni per citodiagnostica
La scelta della colorazione dipende in gran parte dall’origine del campione e dall'esperienza e/o preferenza dell’operatore. Ad esempio, la tecnica di colorazione di Papanicolaou, tipicamente utilizzata per gli strisci ginecologici come il PAP test, può essere impiegata di routine anche per materiale non ginecologico, come espettorato, liquido cerebrospinale, liquido sinoviale e urina. La colorazione di Giemsa è ampiamente utilizzata per i campioni ottenuti mediante FNAB dai linfonodi. La colorazione di Pappenheim è applicata sedimenti urinari, materiale da lavaggio bronchiale o da versamenti e a campioni prelevati mediante FNAB da varie sedi (ad es. mammella, tiroide, liquido cerebrospinale). Quella di Wright è una colorazione ematologica che può essere utilizzata per differenziare le cellule del sangue. Le cellule colorate vengono preparate per l’analisi al microscopio secondo il processo standard che comprende le fasi di disidratazione con etanolo/xilene, diafanizzazione e montaggio. Oltre ai metodi di colorazione manuale, è possibile utilizzare sistemi di colorazione meccanici e automatizzati che consentono di processare un gran numero di campioni. Per lo screening, si può poi ricorrere a un sistema di valutazione completamente automatizzato; in questa fase, vengono contrassegnati le cellule o i gruppi di cellule anormali e le relative immagini vengono salvate per potere essere recuperate e sottoposte a ulteriori indagini.
Interpretazione dell’analisi citodiagnostica
L’esame al microscopio può essere effettuato immediatamente usando le tecniche di fissazione, preparazione e colorazione adeguate. Questa caratteristica rende la citodiagnosi adatta allo screening di grandi volumi di campioni, come quelli della cervice uterina. Un punto critico della citodiagnosi risiede nel fatto che i risultati delle indagini citologiche si riferiscono esclusivamente alla posizione specifica in cui è stato raccolto il campione. Ai fini dell’efficienza, le tecniche di campionamento e preparazione richiedono esperienza e controllo. Per evitare errori nei risultati, andrebbero effettuati controlli adeguati per ogni applicazione.
Il successo e l'efficienza della citologia diagnostica si misurano in base alla sua capacità di rilevare modificazioni molto precoci indicative della malattia (sensibilità) e di evitare diagnosi false positive (specificità). La sensibilità e la specificità dipendono dall’applicazione di procedure corrette nelle singole fasi di raccolta, fissazione, colorazione e interpretazione del campione. Insieme alle tecniche di imaging quali radiografia (raggi X), tomografia computerizzata (TAC), ecografia, tomografia a risonanza magnetica e tomografia a emissione di positroni (PET), la citologia costituisce una componente indispensabile della diagnosi.
Fate una ricerca tra i numerosi documenti disponibili: schede tecniche, certificati e documentazione tecnica.
Articoli tecnici correlati
- Study tumor metastasis via various migration and invasion assays like Boyden chamber assay, Millicell® µ-Migration Assay, and scratch assay.
- Cellular apoptosis assays to detect programmed cell death using Annexin V, Caspase and TUNEL DNA fragmentation assays.
- For good cell attachment the hydrophobic polystyrene surface must be modified to a more hydrophilic surface. This allows cell attachment proteins (vitronectin and fibronectin) found in the serum containing culture medium to adhere and spread on the vessel bottom providing a better surface for cells to attach
- For microbiologists the most fundamental stain was developed in 1884 by the Danish bacteriologist Hans Christian Gram.
- What are primary cells? A comprehensive overview of animal and human primary cell lines and media and how they are used in biomedical cell culture applications. Primary cultures are less homogeneous relative to cell lines.
- Visualizza tutto (8)
Protocolli correlati
- Assay protocol for the colorimetric detection of Hydroxyproline in biological samples using the Hydroxypoline assay kit.
- Trypsin is commonly used for dissociating adherent cells from surfaces. A wide variety of trypsin solutions are available to meet your specific cell line requirements.
- How to use percoll to prepare a gradient
- Visualizza tutto (11)
Per consultare altri articoli e protocolli
Come possiamo aiutarvi
Per qualunque domanda, non esitate a inviare una richiesta di assistenza
o a chiamare il nostro Servizio Clienti:
Email custserv@sial.com
Telefono +1 (800) 244-1173
Altre risorse
- Strumenti di calcolo e app
Strumenti e risorse scientifiche online per la chimica analitica, le life science, la sintesi chimica e la scienza dei materiali.
- Customer Support Request
Assistenza clienti inclusa assistenza per ordini, prodotti, account e problemi tecnici del sito web.
- FAQ
Explore our Frequently Asked Questions for answers to commonly asked questions about our products and services.
Per continuare a leggere, autenticati o crea un account.
Non hai un Account?

