Funzionalizzazione di legami C–H
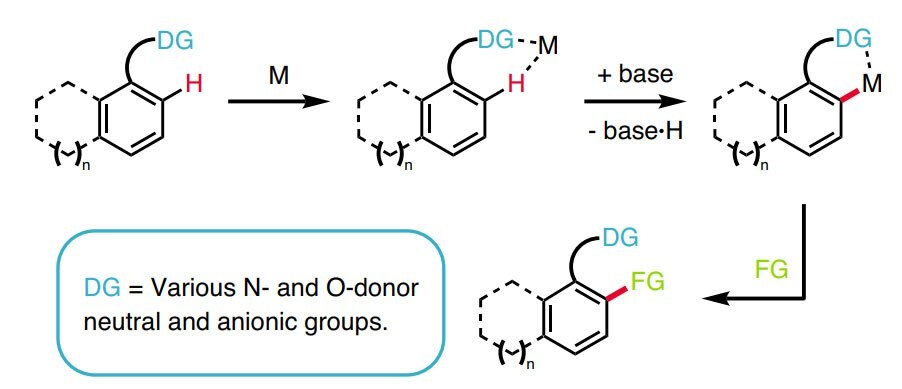
La funzionalizzazione del legame C–H è stata chiamata il Santo Graal della sintesi chimica organica1: negli ultimi anni, gli sforzi compiuti in chimica organica, in metallorganica e nei metodi catalitici hanno portato a significativi passi in avanti nella comprensione della reattività dei legami C–H e, in concomitanza, nello sviluppo di reazioni robuste proprio in virtù dei progressi registrati: i tempi sembrano quindi maturi per un impiego diffuso di queste tattiche nell’ambito dell’analisi retrosintetica.2-11 La trasformazione affidabile e dall’esito predicibile di un legame C–H in un legame C–C, C–N, C–O o C–X, condotta in maniera selettiva e controllata, è vantaggiosa in termini di riduzione dei passaggi di sintesi e dei sottoprodotti di scarto.
Categorie in evidenza
Il vostro fornitore di solventi: scoprite la soluzione ideale tra i marchi Supelco®, SigmaAldrich® e SAFC® che comprendono tutto quello che serve per scopi analitici, di laboratorio e per la produzione biofarmaceutica. È possibile ordinare online.
Trovate i componenti di base necessari per far progredire la vostra ricerca nel nostro portafoglio di building block organici. Alcani, alcheni, alchini, alleni, areni e molto altro!
Il nostro portfolio completo di building block eterociclici è una delle più estese e diversificate collezioni di porzioni molecolari in uso in sintesi organica.
Grazie ad un’ampia offerta di building block fluorurati, quali i sostituenti trifluorometile, difluorometile, triflato e pentafluorosolfanile pronti per la vostra “cassetta degli attrezzi”, rendiamo ancor più facile l’identificazione dei vostri composti target.
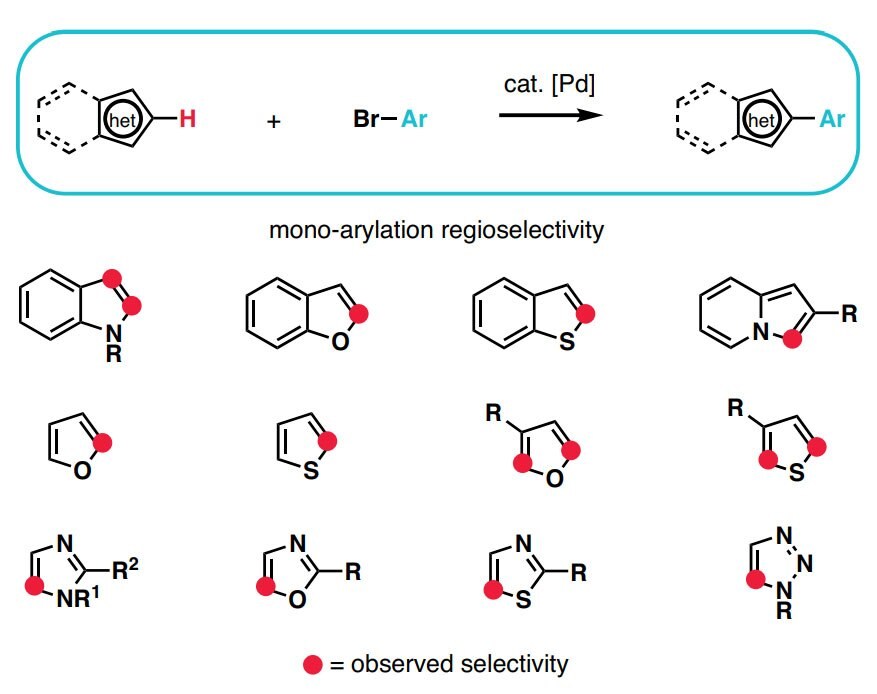
La disponibilità di nuovi metodi di attivazione dei legami C–H amplia il numero dei siti che, in una data molecola, possono essere interessati da funzionalizzazione, aumentando così le possibilità di trasformare la molecola di partenza in un prodotto più complesso. In più, tale disponibilità dà ai chimici organici di sintesi la possibilità di prendere di mira nuove tipologie di legami chimici, e di farlo, in particolare, con elevata chemioselettività. In combinazione con la tradizionale chimica dei gruppi funzionali, la funzionalizzazione dei legami C–H semplifica in modo apprezzabile la sintesi chimica di prodotti naturali complessi e di composti farmaceutici. Anche se i vantaggi insiti nelle logiche di funzionalizzazione dei legami C–H sono ormai ben evidenti,12 ancora oggi molti sono, in chimica organica, i percorsi di studio non al passo con le novità introdotte da questo approccio; ulteriori informazioni sono disponibili nella nostra Guida alla funzionalizzazione dei legami C-H.
Fate una ricerca tra i numerosi documenti disponibili: schede tecniche, certificati e documentazione tecnica.
Articoli tecnici correlati
- Professor Karl Anker Jørgensen and his group have developed ethers which serve as excellent chiral organocatalysts in the direct asymmetric α-functionalization of aldehydes.
- The synthesis of heteroaromatic and aromatic compounds is at the heart of the chemical industry. The ever-growing demand for new chemical entities, coupled with dwindling resources and time constraints allotted to any given research project, a rapid way to diversify (hetero)aromatic scaffolds is needed.
- The Du Bois group at Stanford University has made substantial progress within the field of Rh-catalyzed C–H amination via oxidative cyclization of carbamate, sulfamate, sulfamide, urea, and guanidine substrates to give 1,2- and 1,3-heteroatom motifs masked in the form of 5- and 6-membered ring heterocycles.
- Aryl chlorides are commonly used in cross-coupling reactions and can serve as key intermediates towards the synthesis of pharmaceutical drug candidates and natural products.
- A recyclable, ligand-free ruthenium catalyst for C–H activation reactions and concomitant C–C bond formation in the presence of water.
- Visualizza tutto (10)
Protocolli correlati
- Tips and troubleshooting for FFPE and frozen tissue immunohistochemistry (IHC) protocols using both brightfield analysis of chromogenic detection and fluorescent microscopy.
- Visualizza tutto (0)
Come possiamo aiutarvi
Per qualunque domanda, non esitate a inviare una richiesta di assistenza
o a chiamare il nostro Servizio Clienti:
Email custserv@sial.com
telefono +1 (800) 244-1173
Altre risorse
- Chromatogram Search
Use the Chromatogram Search to identify unknown compounds in your sample.
- Strumenti di calcolo e app
Strumenti e risorse scientifiche online per la chimica analitica, le life science, la sintesi chimica e la scienza dei materiali.
- Customer Support Request
Assistenza clienti inclusa assistenza per ordini, prodotti, account e problemi tecnici del sito web.
- FAQ
Explore our Frequently Asked Questions for answers to commonly asked questions about our products and services.
Riferimenti bibliografici
Per continuare a leggere, autenticati o crea un account.
Non hai un Account?