DNS-károsodás és javítás
DNS-károsodás és javítási mechanizmusok
A sejtek DNS-ének károsodása részt vesz a mutagenezisben és a rák kialakulásában. Az emberi sejt DNS-e naponta több ezer vagy millió károsító eseményen megy keresztül, amelyeket külső (exogén) és belső (endogén) anyagcsere-folyamatok egyaránt okoznak. A sejtgenomban bekövetkező változások hibákat generálhatnak a DNS átírásában és az azt követő, a jelátvitelhez és a sejtműködéshez szükséges fehérjékké történő transzlációban. A genomiális mutációk átvihetők a sejtek leánynemzedékeibe is, ha a mutációt nem javítják ki a mitózis előtt. Ha a sejtek elveszítik a sérült DNS hatékony javítására való képességüket, három lehetséges válaszreakció lehetséges (1. ábra):
- A sejt öregedhet, azaz visszafordíthatatlanul nyugalmi állapotba kerülhet. 2005-ben több laboratórium is beszámolt arról, hogy a szeneszcencia a rákos sejtekben in vivo és in vitro is bekövetkezhet, leállítva a mitózist és megakadályozva a sejt további fejlődését.1-4
- A sejt apoptotikussá válhat. Elegendő DNS-károsodás beindíthat egy apoptotikus jelátviteli kaszkádot, ami programozott sejthalálra kényszeríti a sejtet.
- A sejt rosszindulatúvá válhat, azaz halhatatlan tulajdonságokat fejleszthet ki, és kontrollálatlan osztódásba kezdhet.
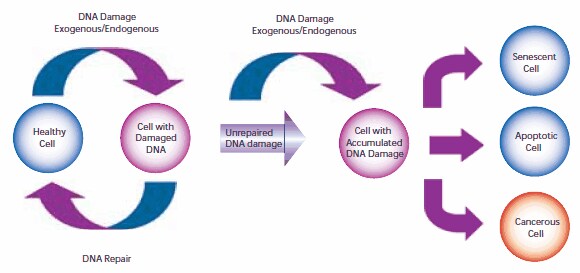
1. ábra.A sejtek DNS-károsodásának és javításának útja, amely az öregedéshez, apoptózishoz vagy rákhoz vezet.
Az előforduló DNS-károsodások mértékének és típusainak kompenzálására a sejtek többféle javítási folyamatot fejlesztettek ki, beleértve a hibás illesztési, báziskiválasztási és nukleotidkiválasztási javítási mechanizmusokat, kevés redundanciával. A sejtek talán úgy fejlődtek ki, hogy apoptózisba vagy szeneszcenciába lépnek, ha túl nagy mértékű károsodás következik be, ahelyett, hogy energiát fordítanának a károsodás hatékony javítására. Az, hogy egy sejt milyen sebességgel képes javításokat végezni, olyan tényezőktől függ, mint a sejttípus és a sejtek életkora.
A DNS-károsodás forrásai
Hosszú évekig úgy gondolták, hogy a rákhoz vezető DNS-mutációk elsődleges oka az exogén károsodási források. Jackson és Loeb azonban azt javasolta, hogy a DNS-károsodás endogén forrásai is jelentősen hozzájárulnak a rosszindulatúsághoz vezető mutációkhoz.5 Mind a környezeti, mind a sejtes források hasonló típusú DNS-károsodást eredményezhetnek.
A DNS-t fizikai és kémiai mutagének támadhatják meg. A fizikai mutagének elsősorban sugárforrások, beleértve a napból származó UV-sugárzást (200-300 nm hullámhosszú). Az UV-sugárzás kovalens kötéseket hoz létre, amelyek keresztkötést hoznak létre a DNS-szálban a szomszédos pirimidin (citozin és timin) bázisok között. Az ionizáló sugárzás (röntgensugárzás) DNS-mutációkat indít el azáltal, hogy a sejtben szabad gyököket hoz létre, amelyek reaktív oxigénfajokat (ROS) hoznak létre, és a kettős spirálban egy- és kétszálas töréseket eredményeznek. A kémiai mutagének kovalens módon alkilcsoportokat kapcsolhatnak a DNS-bázisokhoz; a DNS-bázist metilálni vagy etilálni képes nitrogénmustár-vegyületek példák a DNS-alkiláló szerekre. A prokarcinogének kémiailag inert prekurzorok, amelyek metabolikusan nagy reakcióképességű karcinogénekké alakulnak át. Ezek a karcinogének reagálhatnak a DNS-sel, DNS-adduktokat, azaz a DNS-hez kötődő kémiai egységeket képezve. A benzo[a]pirén, egy poliaromás heterociklus, önmagában nem karcinogén. A citokróm P450 enzimek közvetítésével két egymást követő oxidációs reakción megy keresztül, amelyek eredményeként benzo[a]piréndiol-epoxid (BPDE) keletkezik, a karcinogén metabolit, amely képes kovalens DNS-adduktot képezni (2. ábra).
![A benzo[a]pirént a P450 enzimek oxidálják, és a rendkívül rákkeltő benzo[a]pirén-diolepoxidot hozzák létre. A benzo[a]pirént a P450 enzimek oxidálják, és a rendkívül rákkeltő benzo[a]pirén-diolepoxidot hozzák létre.](/deepweb/assets/sigmaaldrich/marketing/global/images/technical-documents/articles/research-and-disease-areas/cancer-research/dna-damage-and-repair-figure2.gif)
2. ábra.A benzo[a]pirént a P450 enzimek oxidálják, és a rendkívül rákkeltő benzo[a]pirén-diolepoxidot hozzák létre.
A DNS-károsodás endogén metabolikus és biokémiai reakciókból is eredhet, amelyek közül néhányat nem ismerünk jól.6 A hidrolízisreakciók részben vagy teljesen lehasíthatják a nukleotid bázist a DNS-szálról. A purinbázist (adenin vagy guanin) a dezoxiribozil-foszfátlánchoz kötő kémiai kötés spontán módon elszakadhat a depurinációnak nevezett folyamat során. Becslések szerint naponta 10 000 depurinációs esemény történik egy emlőssejtben.7 Depirimidináció (pirimidin bázis elvesztése a timinről vagy citozinról) szintén előfordul, de 20-100-szor kisebb arányban, mint a depurináció.
A dezamináció a sejtben történik az adenin-, guanin- és citozingyűrűk amincsoportjainak elvesztésével, ami hipoxantint, xantint, illetve uracilt eredményez. A DNS-javító enzimek képesek felismerni és korrigálni ezeket a természetellenes bázisokat. A nem korrigált uracil bázist azonban a későbbi DNS-replikáció során tévesen timinnek olvassák, és C→T pontmutációt hozhatnak létre.
A DNS-metiláció, az alkiláció egy speciális formája, a sejtben az S-adenozil-metioninnal (SAM) való reakció következtében jön létre. A SAM egy intracelluláris metabolikus intermedier, amely egy erősen reaktív metilcsoportot tartalmaz. Emlőssejtekben a metiláció a citozin bázis (C) citozingyűrűjének 5' pozíciójában történik, amely 5'-re van egy guanozin bázistól (G), azaz a CpG szekvenciában. A mutációs hibák jelentős forrása a metiláció 5-metilcitozin termékének spontán deaminációja. Az amincsoport elvesztése timin bázist eredményez, amelyet a DNS-javító enzimek nem érzékelnek természetellenes bázisként. Az így keletkezett szubsztitúció a DNS-replikáció során megmarad, és C→T pontmutációt hoz létre (3. ábra).
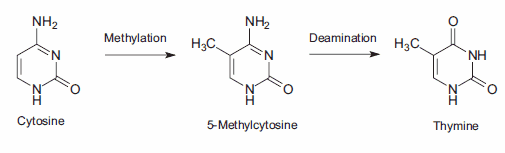
3. ábra.A citozin 2-fázisú mutációja timinhez vezet, ami C→T pontmutációt eredményez.
A normál anyagcsere-folyamatok reaktív oxigénfajokat (ROS) termelnek, amelyek oxidációval módosítják a bázisokat. Mind a purin-, mind a pirimidinbázisok oxidációnak vannak kitéve. A leggyakoribb mutáció a guanin 8-oxo-7,8-dihidroguaninná oxidálódik, ami a 8-oxo-deoxi-guaninsin (8-oxo-dG) nukleotidot eredményezi. A 8-oxo-dG képes bázispárosodni a dezoxiadenozinnal, ahelyett, hogy a várt módon dezoxicitotidinnel párosodna. Ha ezt a hibát nem észlelik és nem javítják ki a hibás illeszkedést javító enzimek, a később replikálódó DNS egy C→A pontmutációt fog tartalmazni. A ROS depurinációt, depirimidinációt és egy- vagy kétszálas töréseket is okozhat a DNS-ben.
A sejtciklus S fázisában a DNS-replikáció során egyéb genomiális mutációk is bevezethetők. A sablon DNS-t duplikáló polimerázok kis, de jelentős hibaaránnyal rendelkeznek, és a Watson-Crick párosítás alapján hibás nukleotidot építhetnek be a sablon DNS-sel szemben. Kémiailag módosított nukleotid-prekurzorokat építhet be a polimeráz a normál bázisok helyett a létrehozott DNS-be. Ezenkívül a polimerázok hajlamosak a "dadogásra", amikor olyan DNS-szakaszokat másolnak, amelyek nagyszámú ismétlődő nukleotidot vagy ismétlődő szekvenciát tartalmaznak (mikroszatellita régiók). Ez az enzimatikus "dadogás" a szálcsúszás miatt következik be, amikor a templát és a replikált DNS-szálak kicsúsznak a megfelelő illeszkedésből. Ennek következtében a polimeráz nem illeszti be a sablon DNS által megadott számú nukleotidot, így a leányszálban túl kevés vagy túl sok nukleotid keletkezik.
A DNS egyszálú és kétszálú hasadása is előfordulhat. Az egyszálú törések a DNS dezoxiribózlánc dezoxiriboszil-foszfátlánc dezoxiribóz-részének károsodásából eredhetnek. A törések a báziskivágási javítási útvonal köztes lépéseként is létrejönnek, miután az AP-endonukleáz 1 eltávolítja a dezoxiribóz-foszfátot.8 Egyszálú törés esetén a DNS szerkezetéből mind a nukleotid bázis, mind a dezoxiribóz gerinc elveszik. Kettős szálhasadás leggyakrabban akkor következik be, amikor a sejt az S-fázison halad át, mivel a DNS érzékenyebb lehet a törésre, miközben kibontakozik, hogy sablonként szolgáljon a replikációhoz.
A DNS-javítás mechanizmusai
Míg a sejt képes apoptotikus vagy szeneszcens állapotba fejlődni, ezeket a műveleteket végső megoldásként hajtják végre. A DNS-károsodás minden egyes típusára a sejt sajátos módszert fejlesztett ki a károsodás javítására vagy a károsító vegyület eltávolítására.
O6-metilguanin DNS-metiltranszferáz (MGMT; DNS-alkiltranszferáz) mind a metil-, mind az etil-adduktokat lehasítja a DNS-szerkezet guaninbázisairól. A reakció nem katalitikus (enzimatikus) reakció, hanem sztöchiometrikus (kémiai), minden egyes eltávolított adduktra egy MGMT-molekula jut. Azok a sejtek, amelyeket úgy alakítottak át, hogy túlreprezentálják az MGMT-t, ellenállóbbak a rák ellen, valószínűleg azért, mert nagyobb mennyiségű alkiláló károsodást képesek negligálni. Niture és munkatársai egy nemrégiben készült tanulmánya arról számol be, hogy a cisztein/glutationt fokozó gyógyszerek és természetes antioxidánsok alkalmazásával fokozódik az MGMT expressziója.9
A DNS-polimerázok, mint például a polimeráz-δ, korrektúraolvasó tevékenységet tartalmaznak, és elsősorban a replikációs hibajavításban vesznek részt. Hiba észlelésekor ezek a polimerázok leállítják a DNS-replikáció folyamatát, visszafelé haladva addig dolgoznak, hogy eltávolítsák a nukleotidokat a leány DNS-láncból, amíg nyilvánvalóvá nem válik, hogy a hibás nukleotid eltűnt, majd újraindítják az előre irányuló replikációs folyamatot. A Pold1 gén mindkét kópiájában pontmutációval rendelkező egerek a DNS-polimeráz-δ korrektúraolvasó aktivitásának elvesztését mutatták, és szignifikánsan nagyobb arányban alakultak ki bennük epithelialis rákok, mint a vad típusú génekkel rendelkező vagy az egy kópia mutációjával rendelkező egerekben.10
A mismatch excision repair (MMR) enzimek néven ismert fehérjecsoport képes a DNS-polimeráz proofreading tevékenysége által nem észlelt replikációs hibák kijavítására. Az MMR enzimek kivágják a hibás nukleotidot a leány DNS-ből, és a W-C párosítás és a szülő DNS-szál mint helyes sablon felhasználásával javítják a szálat.11 Ez különösen fontos a mikroszatellita régiók replikációja során keletkező hibák esetében, mivel a DNS-polimeráz korrektúraolvasó tevékenysége nem észleli ezeket a hibákat. Kisebb mértékben az MMR enzimek a DNS oxidációjából vagy alkilációjából eredő különféle bázispár-anomáliákat is korrigálják. Ezek a mutációk közé tartoznak az O6-metilguanint és 8-oxoguanint tartalmazó módosított bázispárok, valamint a karcinogén és ciszplatin adduktok.12,13 A humán MSH2 és MLH1 mismatch excision repair gének mutációi kapcsolatban állnak az örökletes nem polipozitású vastagbélrákkal (HNPCC) szindrómával.14
Báziskiválasztási javítás és nukleotidkiválasztási javítás
A bázis exzíciós javítás (BER) több enzim bevonásával történik, amelyek egyetlen sérült nukleotidbázist kimetszenek és kicserélnek. A BER enzimek elsősorban az endogén oxidáció és hidrolízis által károsodott bázismódosításokat javítják. Egy DNS-glikoziláz hasítja a nukleotidbázis és a ribóz közötti kötést, érintetlenül hagyva a DNS ribóz-foszfátláncát, de egy apurinikus vagy apirimidinikus (AP) helyet eredményezve. A 8-oxoguanin-DNS-glikoziláz I (Ogg1) eltávolítja a 7,8-dihidro-8-oxoguanint (8-oxoG), a reaktív oxigénfajok által létrehozott bázismutációk egyikét. Az emberi OGG1 gén polimorfizmusa összefüggésbe hozható a különböző rákos megbetegedések, például a tüdő- és prosztatarák kockázatával. Az uracil-DNS-glikoziláz, egy másik BER-enzim, kivágja a citozin-deamináció termékét képező uracilt, ezáltal megakadályozza a későbbi C→T pontmutációt.15 Az N-metilpurin-DNS-glikoziláz (MPG) számos módosított purinbázist képes eltávolítani.16
A BER-enzimek hatására keletkező AP-helyeket a DNS-ben, valamint a depirimidinációs és depurinációs műveletekből eredő AP-helyeket az AP-endonukleáz 1 (APE1) működése javítja. Az APE1 az AP-helytől 5'-re hasítja a foszfodiészterláncot. A DNS-szál ezután egy 3'-hidroxilcsoportot és egy 5'-abázikus dezoxiribóz-foszfátot tartalmaz. A DNS-polimeráz β (Polβ) beilleszti a megfelelő nukleotidot a megfelelő W-C párosítás alapján, és a hozzá kapcsolódó AP-lyáz aktivitás révén eltávolítja a dezoxiribóz-foszfátot. Az X-ray repair cross-complementing group 1 (XRCC1) jelenléte szükséges ahhoz, hogy heterodimert képezzen a DNS-ligáz III-mal (LIG3). Az XRCC1 állványfehérje, amely nem reaktív kötőhelyet biztosít a Polβ számára, és összehozza a Polβ és a LIG3 enzimeket a javítás helyén.17 A poli(ADP-ribóz) polimeráz (PARP-1) kölcsönhatásba lép az XRCC1-gyel és a Polβ-vel, és a BER-útvonal szükséges összetevője.18,19 A javítás utolsó lépését a LIG3 végzi, amely a helyettesítő nukleotid dezoxiribózát a dezoxiriboszilfoszfát gerincéhez kapcsolja. Ezt az útvonalat "short-patch BER"-nek nevezték el.20
Egy alternatív útvonal, amelyet "long-patch BER"-nek neveznek, egy legalább 2 nukleotid hosszúságú nukleotidszálat cserél ki. A 10-12 nukleotid hosszúságú javításról is beszámoltak.21,22 A longpatch BER megköveteli a proliferációs sejtmag antigén (PCNA) jelenlétét, amely az átstrukturáló enzimek számára vázfehérjeként működik.23 Más DNS-polimerázok, valószínűleg a Polδ és a Polε, 24 az oligonukleotidlapka létrehozásához. A meglévő nukleotidszekvenciát a flap endonukleáz-1 (FEN1) távolítja el. Az oligonukleotidot ezután a DNS-ligáz I (LIG1) ligálja a DNS-hez, lezárva a törést és befejezve a javítást.17 A rövid foltos és a hosszú foltos BER-útvonalak kiválasztásának meghatározására használt folyamatot még vizsgálják (4. ábra).25
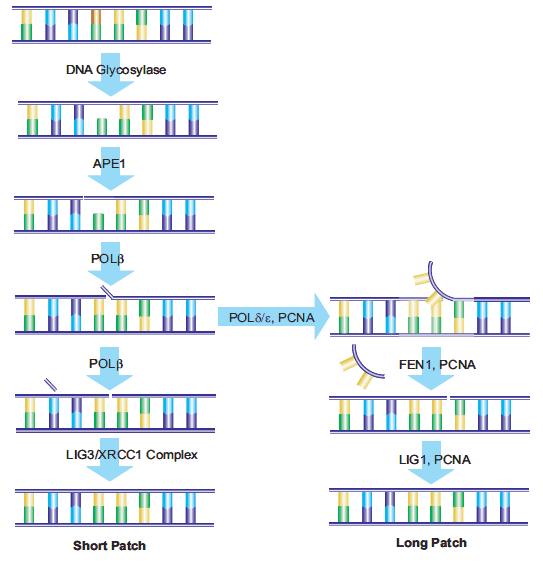
4. ábra.A rövid és a hosszú csatolású BER-útvonalak vázlata.
Míg a BER több nukleotidot is kicserélhet a long-patch útvonalon keresztül, mind a short-patch, mind a long-patch BER esetében egyetlen nukleotid sérülése a kiindulási esemény, ami minimális hatást gyakorol a DNS kettős spirál szerkezetére. A nukleotid exzíciós javítás (NER) egy nukleotidszál sérülését javítja, amely legalább 2 bázist tartalmaz, és a DNS szerkezeti torzulását okozza. A NER az exogén forrásokból, például terjedelmes DNS-adduktokból és UV-sugárzásból származó sorozatos károsodásokon kívül az egyszálú szálszakadások javítására is hat. 26 Ugyanez az útvonal használható az oxidatív stressz okozta károsodások javítására is.27 Több mint 20 fehérje vesz részt a NER-útvonalban emlőssejtekben, köztük az XPA, az XPC-hHR23B, a replikációs fehérje A (RPA), a TFIIH transzkripciós faktor, az XPB és XPD DNS-helikázok, az ERCC1-XPF és XPG, a Polδ, a Polε, a PCNA és a replikációs faktor C is.28 Az excision repair cross-complementing (ERCC1) gén overexpresszióját nem kissejtes tüdőráksejtek29 ciszplatinrezisztenciájával hozták összefüggésbe, ami a fokozott DNS-javító képességnek felel meg.30 A globális genomiális NER (GGR) az egész genomban javítja a károsodásokat, míg egy specifikus NER-útvonal, az úgynevezett transzkripciós kapcsolt javítás (TCR) az aktív RNS-polimeráz transzkripció során javítja a géneket.31
Kettősszál-törések javítása
A DNS kettősszál-törései a genomi szekvenciák elvesztését és átrendeződését eredményezhetik. Ezeket a töréseket vagy a nem-homológ vég-összekötődés (NHEJ), vagy a homológ rekombináció (HR), más néven rekombinációs javítás vagy sablon-asszisztált javítás javítja.
A HR útvonal akkor aktiválódik, amikor a sejt a késői S/G2 fázisban van, és a sablon nemrég duplikálódott. Ez a mechanizmus megköveteli egy azonos vagy közel azonos szekvencia jelenlétét, amely a centromeren keresztül kapcsolódik a sérült DNS-régióhoz, hogy javító sablonként használható legyen. Az ezzel a mechanizmussal javított kettősszálú töréseket általában az okozza, hogy a replikációs gépezet egyszálú törésen vagy javítatlan sérülésen keresztül próbál szintetizálni, ami a replikációs villa összeomlásához vezet.
A nem-homológ végcsatlakozást (NHEJ) a sejtciklus más pontjain használják, amikor a testvérkromatidák nem állnak rendelkezésre HR-templátként való felhasználásra. Amikor ezek a törések bekövetkeznek, a sejt még nem replikálta a törést tartalmazó DNS-régiót, így a HR útvonallal ellentétben nem áll rendelkezésre megfelelő templát szál. Az NHEJ során a Ku heterodimer fehérje a törött DNS-szálak két végét pozícionálja a javításhoz, rendelkezésre álló templát nélkül, miközben a folyamat során szekvenciainformációt veszít. Az újraegyesítésben több enzim vesz részt, köztük a DNS-ligáz IV, az XRCC4 és a DNS-függő fehérje kináz (DNA-PK).32,33 Az NHEJ eredendően mutagén, mivel a két összekapcsolandó DNS-fragmentum egyszálú végei közötti véletlen párosításokra, úgynevezett mikrohomológiákra támaszkodik (5. ábra). Magasabb eukariótákban a DNS-PK szükséges az NHEJ javításhoz, mind az elsődleges mechanizmuson, mind egy alternatív tartalékmechanizmuson (D-NHEJ) keresztül.34
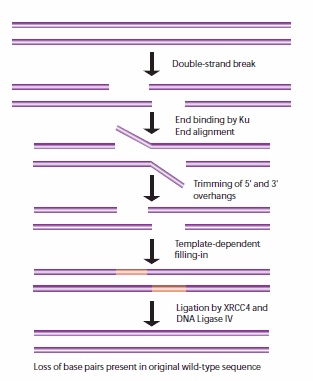
5. ábra.A DNS kettősszál-törések NHEJ-javításának általános mechanizmusa.
Jövőbeni alkalmazások
Míg a DNS-károsodás kulcsfontosságú tényező a rákos sejtek kialakulásában és evolúciójában, a rák klinikai kezelésének részeként folyamatos károsodást alkalmaznak a rosszindulatú sejtek apoptózisba vagy szeneszcenciába kényszerítésével. Számos kemoterápiás gyógyszer, például a bleomicin, a mitomicin és a ciszplatin azért hatékony, mert további DNS-károsodást okoz a rákos sejtekben, amelyek gyorsabban szaporodnak, mint a környező szövetek. A sejtek DNS-javító mechanizmusai kétélű kardot jelentenek; a rákhoz vezető mutációk csökkentésével ezek a folyamatok a genomi integritásra törekszenek, de ugyanezek a mechanizmusok a rosszindulatú sejtekben lehetővé teszik, hogy ezek a sejtek további DNS-károsodásokat éljenek túl és folytassák a kontrollálatlan növekedést. A rákos sejteken belüli túlélési mechanizmus blokkolása érdekében jelenleg klinikai kísérletek folynak a specifikus DNS-javító enzimek, köztük az MGMT, a PARP és a DNA-PK gátlóival.35-38
Anyagok
Hivatkozások
Az olvasás folytatásához jelentkezzen be vagy hozzon létre egy felhasználói fiókot.
Még nem rendelkezik fiókkal?