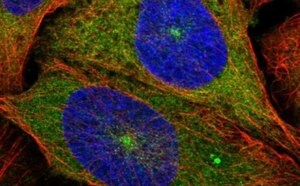
Proteinstrukturanalyse

Die Funktion eines Proteins hängt direkt von seiner Struktur, seinen Wechselwirkungen mit anderen Proteinen und seiner Lokalisation innerhalb von Zellen, Geweben und Organen ab. Die Struktur und Funktion von Proteinen wird in großem Rahmen in der Proteomik untersucht, die eine Identifizierung der mit spezifischen Krankheitszuständen assoziierten Protein-Biomarkern sowie potenzieller Wirkstofftargets für therapeutische Behandlungen ermöglicht. Das Verständnis der Proteinstruktur und die Bestimmung der Lokalisation, Expressionsniveaus und Wechselwirkungen können wertvolle Informationen liefern, aus denen Rückschlüsse auf die Proteinfunktion gezogen werden können.
• Proteinstruktur
• Bestimmung der Proteinstruktur
• Protein-Mapping
Ausgewählte Kategorien
Prestige Antibodies®, die auf der Grundlage von mit verschiedenen Methoden validierten Human-Protein-Atlas-Daten entwickelt wurden, sind zuverlässige Forschungsinstrumente.
Informieren Sie sich über hochreine biologische Puffer in verschiedenen Formulierungen und Verpackungsformaten, um eine hervorragende Lösungsstabilität und pH-Kontrolle für Ihre Bioprozess-Workflow-Anwendungen zu erhalten.
Stabile Isotope der Marke ISOTEC® sind für Tracer-Studien in der Proteomik und Metabolomik, als Agenzien für MRT/MRS und in einer Vielzahl anderer biomedizinischer Anwendungen von Nutzen.
Wir bieten eine breite Palette an Kryobedarfsartikeln wie Gefriergestelle, Röhrchen & Fläschchen, Etiketten & Marker sowie Zangen für Forschung und klinische Anwendungen von den zuverlässigsten Anbietern der Branche.
Proteinstruktur
Die Proteinstruktur wird durch die Sequenz der Aminosäuren bestimmt, aus denen das Protein besteht, und wie sich das Protein in komplexere Formen faltet.
- Die Primärstruktur wird durch die Aminosäuresequenz des Proteins bestimmt.
- Die Sekundärstruktur wird durch lokale Wechselwirkungen von Abschnitten der Polypeptidkette bestimmt, die α-Helices und β-Faltblätter durch Wasserstoffbindungen ausbilden können.
- Die Tertiärstruktur bestimmt die allgemeine dreidimensionale Struktur des Proteins.
- Die Quartärstruktur bestimmt, wie mehrere Protein-Untereinheiten interagieren, um größere Komplexe zu bilden.
Bestimmung der Proteinstruktur
Die Bestimmung der dreidimensionalen Proteinstrukturen mit atomarer Auflösung ist hilfreich bei der Aufklärung der Proteinfunktion, dem strukturbasierten Wirkstoffdesign und beim molekularen Docking.
- NMR: Die NMR-Spektroskopie wird angewendet, um Informationen über die Struktur und Dynamik von Proteinen zu erhalten. Bei der NMR, wird die räumliche Lokalisation von Atomen anhand ihrer chemischen Verschiebungen bestimmt. Für die Protein-NMR werden Proteine typischerweise mit stabilen Isotopen (15N, 13C, 2H) markiert, um die Empfindlichkeit zu erhöhen und die Strukturentfaltung zu erleichtern. Isotopenmarker werden typischerweise durch Bereitstellung isotopisch markierter Nährstoffe im Nährmedium während der Proteinexpression eingebracht.
- Röntgen-Kristallographie: Die Röntgen-Kristallographie kann eingesetzt werden, um die dreidimensionale Struktur von Proteinen durch Röntgendiffraktion kristallisierter Proteine zu erhalten. Kristalle werden gezüchtet, indem hochkonzentrierte Proteine in präzipitationsfördernde Lösungen eingebracht werden, wobei sich unter geeigneten Bedingungen geordnete Proteinkirstalle bilden. Röntgenstrahlen werden auf das Proteinkristall gerichtet, das diese auf einen elektronischen Detektor oder Film streut. Die Kristalle werden rotiert, um die Diffraktion in drei Dimensionen zu erfassen, so dass die Position jedes Atoms im kristallisierten Molekül mittels Fourier-Transformation berechnet werden kann.
Protein-Mapping
Die Bestimmung der Lokalisation und des Expressionsniveaus von Proteinen in spezifischen Zellen, Geweben und Organen erleichtert die Funktionsuntersuchung des Proteoms. Die räumliche Verteilung von Proteinen ist wichtig für die Proteinfunktion, wobei eine falsche Lokalisation oder Expression verschiedene Krankheitszustände auslösen kann. Mapping-Projekte wie der Human Protein Atlas stellen eine proteomische Bezugsquelle für die Biomarker-Entdeckung dar und verbessern das Verständnis pathologischer Prozesse. Die Lokalisation des Interaktoms hilft bei der Definition molekularer Wechselwirkungen, die auf Zellebene stattfinden, wodurch das Verständnis der Proteinfunktion verbessert wird und zahlreiche potenzielle Wirkstofftargets für Krankheiten entdeckt werden können.
Besuchen Sie unsere Dokumentensuche, wo Sie Datenblätter, Zertifikate und technische Dokumentation finden.
Zugehörige Artikel
- Amino acid reference chart contains the twenty amino acids found in eukaryotes, grouped according to their side chains and charge. Discover our full product line of amino acids, including Alanine, Isoleucine, Leucine, Valine, Phenylalanine, Tryptophan, Tyrosine, Aspargine, Cysteine, Glutamine, Methionine, Serine, Threonine, Aspartic acid, Glutamic acid, Arginine, Histidine, Lysine, Glycine and Proline. Learn more today.
- The human protein atlas has an aim of mapping all human proteins within cells, tissues and organs and providing open-access information to advance understanding of human biology and disease.
- Information on Isoelectric Focusing including what it is and how it is used. In order to ensure the high performance of analysis, isoelectric point (pI) standards are needed.
- We presents an informational article concerning biomolecular NMR and the use of Isotope Labeling Methods for Protein Dynamics Studies.
- Glycosylphosphatidylinisotol (GPI) anchored proteins are membrane bound proteins found throughout the animal kingdom. GPI anchored proteins are linked at their carboxyterminus through a phosphodiester linkage of phosphoethanolamine to a trimannosyl-non-acetylated glucosamine (Man3-GlcN) core.
- Alle anzeigen (10)
Zugehörige Protokolle
- This page covers the principles and methods of chromatofocusing, a chromatography technique that separates proteins according to differences in their isoelectric point (pI).
- Protein Structural Analysis
- This protocol describes a method for chemical cross-linking of proteins using formaldehyde. With the exception of zero-length cross-linkers, formaldehyde has the shortest cross-linking span (~2-3 Å) of any cross-linking reagent, thus making it an ideal tool for detecting specific protein-protein interactions with great confidence.
Mehr Artikel und Protokolle finden
Wie wir weiterhelfen können
Sollten Sie Fragen haben, reichen Sie bitte eine Anfrage beim Kundensupport
ein oder sprechen Sie mit unserem Kundenservice:
E-Mail custserv@sial.com
oder telefonisch unter +1 (800) 244-1173
Weitere Unterstützung
- Chromatogram Search
Use the Chromatogram Search to identify unknown compounds in your sample.
- Rechner & Apps
Web-Toolbox - wissenschaftliche Forschungstools und Informationsquellen für die Bereiche analytische Chemie, Life Science, chemische Synthese und Materialwissenschaft.
- Customer Support Request
Customer support including help with orders, products, accounts, and website technical issues.
- FAQ
Explore our Frequently Asked Questions for answers to commonly asked questions about our products and services.
Um weiterzulesen, melden Sie sich bitte an oder erstellen ein Konto.
Sie haben kein Konto?