Peptidsynthese
Ein Peptid besteht aus zwei oder mehr Aminosäuren, die durch eine Amidbindung miteinander verbunden sind und so eine Kette von Aminosäuren bilden, die in der Regel 2 bis 70 Aminosäuren lang ist. Peptide unterscheiden sich von Proteinen dadurch, dass sie keine Faltung erfordern, um biologisch aktiv zu sein. Peptide kommen endogen als Peptidhormone, wie Angiotension, LHRH, Enkephalin, und als Toxine in Pflanzen und Tieren vor. Peptide sind als Leitstrukturen für die Wirkstoffforschung und als eigenständige Therapeutika von großem Interesse. Sie finden darüber hinaus Anwendung in Impfstoffen, Biomaterialien und histologischen Sonden und werden in großer Zahl als Antigene zur Herstellung von Antikörpern verwendet.
Peptide werden entweder in Lösung oder an einer festen Phase chemisch synthetisiert. Das Verfahren beinhaltet die gezielte und selektive Bildung einer Amidbindung zwischen einer N-geschützten Aminosäure und einer Aminosäure mit einer freien Aminogruppe und einer geschützten Carbonsäure. Bei der Festphasensynthese wird die Carboxylschutzgruppe an einen Polymerträger gebunden. Nach der Bindungsbildung wird die Aminoschutzgruppe des Dipeptids entfernt, und die nächste N-geschützte Aminosäure gekoppelt.
Ausgewählte Kategorien
Wir bieten ein umfangreiches Sortiment an hochwertigen Aminosäuren, Harzen und Reagenzien, darunter Novabiochem® für die Peptidsynthese, organische Hochdurchsatzchemie, Markierungspeptide sowie maßgeschneiderte Lösungen.
Unsere stabilen und verträglichen NHC-Liganden und -Komplexe können als effiziente Hilfsliganden verwendet werden, um Ihre Arbeit in der metallorganischen Katalyse und der Forschung in der chemischen Katalyse voranzubringen.
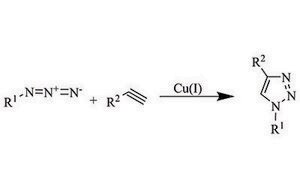
Unser Portfolio an Reagenzien für die Click-Chemie umfasst eine Vielzahl von Aziden, Alkinen, Katalysatoren und Liganden, um Ihren Fortschritt in der chemischen Biologie, Polymerchemie, Biokonjugation und Arzneimittelforschung zu beschleunigen.
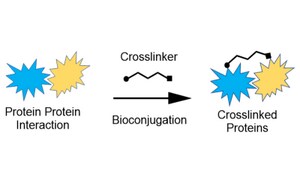
Unser Portfolio aus Linkern und Vernetzern bietet strukturelle Stabilität und Zuverlässigkeit in Protein-Protein-, Protein-Peptid- und Peptid/Protein-Kleinmolekül-Interaktionen für Ihre Anforderungen in der Biokonjugation.
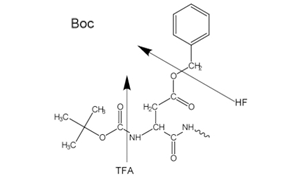
Figure 2Side-chain protecting groups for Boc solid-phase peptide synthesis (SPPS)
Die Festphasen-Peptidsynthese (SPPS) ist aufgrund ihrer Effizienz, Einfachheit, Geschwindigkeit und leichten Parallelisierbarkeit die am häufigsten verwendete Methode der Peptidsynthese. Bei der SPPS werden nacheinander Amino- und seitenkettengeschützte Aminosäurereste einer Aminosäure oder einem Peptid hinzugefügt, die/das an einen unlöslichen Polymerträger angelagert ist (Abbildung 1).
Für den N-α-Schutz wird entweder eine säurelabile Boc-Gruppe (Boc SPPS) oder eine basenlabile Fmoc-Gruppe (Fmoc SPPS) verwendet. Nach Entfernung dieser Schutzgruppe wird die nächste geschützte Aminosäure entweder mit einem Kupplungsreagenz oder einem zuvor aktivierten geschützten Aminosäurederivat hinzugefügt. Die C-terminale Aminosäure ist über einen Linker am Harz verankert, dessen Art die Bedingungen bestimmt, die erforderlich sind, um das Peptid nach der Kettenverlängerung vom Träger zu lösen. Die Schutzgruppen der Seitenketten werden häufig so gewählt, dass sie gleichzeitig mit der Ablösung des Peptids vom Harz abgespalten werden (Abbildung 2 und 3).
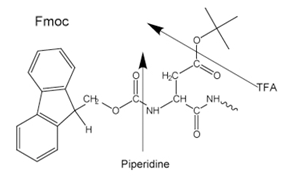
Figure 3.Side-chain protecting groups for Fmoc solid-phase peptide synthesis (SPPS)
Die meisten Peptide werden nach der Fmoc-Methode hergestellt, da die abschließende Spaltung und Entschützung durch Behandlung mit Trifluoressigsäure erfolgt, im Gegensatz zur Boc-Methode, die den Einsatz von hochtoxischem, korrosivem, flüssigem, wasserfreiem HF in Spezialgeräten erfordert.
Routinemäßig lassen sich Peptide mit 50 Aminosäuren herstellen, aber auch die Synthese von Proteinen mit mehr als 100 Aminosäuren wird häufig beschrieben. Längere Proteine können durch native chemische Ligation vollständig entschützter Peptide in Lösung hergestellt werden. Mit dieser Methode lassen sich natürliche Peptide synthetisieren, die in Bakterien schwer zu exprimieren sind, unnatürliche oder D-Aminosäuren einbauen sowie zyklische, verzweigte, markierte und posttranslational modifizierte Peptide erzeugen.
Die Flüssigphasenpeptidsynthese, bei der in der Regel ein Boc- oder Z-Aminoschutz verwendet wird, wurde durch die Festphasenpeptidsynthese ersetzt. Eine Ausnahme bilden bestehende großtechnische Verfahren für die gewerbliche Peptidsynthese.
Besuchen Sie unsere Dokumentensuche, wo Sie Datenblätter, Zertifikate und technische Dokumentation finden.
Zugehörige Artikel
- Novabiochem® has one of the most extensive ranges of linkers and derivatized resins for Fmoc solid phase peptide synthesis. These resins have varied properties with special protocols for loading and cleaving.
- Chromogenic and fluorogenic derivatives are invaluable tools for biochemistry, having numerous applications in enzymology, protein chemistry, immunology and histochemistry.
- Aspartimide formation 1,2 is caused by repeated exposure of aspartic acid-containing sequences to bases like piperidine and can result ultimately in the generation of 9 different by-products.
- The Novabiochem® product line has one of the most extensive ranges of polymer-supports for solid phase peptide synthesis. They range from high-loaded, lows welling for the large-scale production of relatively short peptides to high-swelling, low-loaded for the synthesis of long or difficult sequences.
- Our long peptide purification utilizes a combination of chemoselective purification tags and standard RP-HPLC. The method is especially effective at removing impurities that are closely eluting or hidden under the isolated product peak
- Alle anzeigen (22)
Zugehörige Protokolle
- A guide to create solvent systems used for the thin-layer chromatography assay of Novabiochem products.
- Overcome challenges in synthesis and disulfide bond formation with protocols for Fmoc solid-phase peptide synthesis of peptides with cysteine and methionine.
- Amide Coupling in a Box
- Information on the Amide bond and the Catalytic Amide Bond Formation Protocol. Amidation of amines and alcohols. The amide bond, an important linkage in organic chemistry, is a key functional group in peptides, polymers, and many natural products and pharmaceuticals.
- We provide an overview of our available reagents, together with recommendations and details of their use for synthesis of peptides containing post-translationally modified amino acids.
- Alle anzeigen (10)
Mehr Artikel und Protokolle finden
Wie wir weiterhelfen können
Sollten Sie Fragen haben, reichen Sie bitte eine Anfrage beim Kundensupport
ein oder sprechen Sie mit unserem Kundenservice:
E-Mail custserv@sial.com
oder telefonisch unter +1 (800) 244-1173
Weitere Unterstützung
- Chromatogram Search
Use the Chromatogram Search to identify unknown compounds in your sample.
- Rechner & Apps
Web-Toolbox - wissenschaftliche Forschungstools und Informationsquellen für die Bereiche analytische Chemie, Life Science, chemische Synthese und Materialwissenschaft.
- Customer Support Request
Customer support including help with orders, products, accounts, and website technical issues.
- FAQ
Explore our Frequently Asked Questions for answers to commonly asked questions about our products and services.
Um weiterzulesen, melden Sie sich bitte an oder erstellen ein Konto.
Sie haben kein Konto?